题目内容
4.下面叙述正确的是( )| A. | 工业上用过量的碳还原二氧化硅而得到作为半导体材料的硅 | |
| B. | 二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维 | |
| C. | 水玻璃中加入少量盐酸出现白色沉淀,盐酸过量时,沉淀溶解 | |
| D. | 在Si+2NaOH+H2O═Na2SiO3+2H2↑反应中,NaOH和水均作氧化剂 |
分析 A.过量的碳能够与硅反应生成碳化硅;
B.依据二氧化硅的用途解答;
C.硅酸不溶于盐酸;
D.氧化剂是水.
解答 A.工业上用过量的碳还原二氧化硅生成碳化硅,不能得到硅,故A错误;
B.二氧化硅除可用于制作光学镜片、石英坩埚外,还可用于制造光导纤维,故B正确;
C.水玻璃中加入少量盐酸出现白色沉淀,硅酸不溶于盐酸,所以盐酸过量时,沉淀不溶解,故C错误;
D.在Si+2NaOH+H2O═Na2SiO3+2H2↑反应中水氧化剂,故D错误;
故选:B.
点评 本题考查了硅及其化合物性质和用途,性质决定用途,明确硅及其化合物的性质是解题关键,注意相关知识的积累,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
14.在密闭容器中进行反应:X(g)+4Y(g)?2Z(g)+3W(g),其中X、Y、Z、W的起始浓度分别为0.1mol•L-1、0.4mol•L-1、0.2mol•L-1、0.3mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度不可能是( )
| A. | c(X)=0.15mol•L-1 | B. | c(Y)=0.9mol•L-1 | C. | c(Z)=0.3mol•L-1 | D. | c(W)=0.6mol•L-1 |
19.若a mol H2SO4中含有b个氧原子,则阿伏加德罗常数可表示为( )
| A. | $\frac{a}{4b}$mol-1 | B. | $\frac{4b}{a}$ mol-1 | C. | $\frac{a}{b}$ mol-1 | D. | $\frac{b}{4a}$ mol-1 |
20.下列说法不正确的是( )
| A. | 原电池工作时电流由负极经外电路流向正极 | |
| B. | 原电池工作时,电解质溶液中的阳离子向正极移动 | |
| C. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| D. | 电解氯化铜溶液时,铜在阴极上析出 |
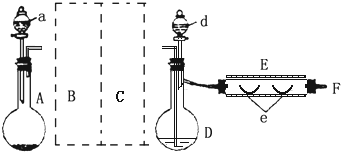 实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)
实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)