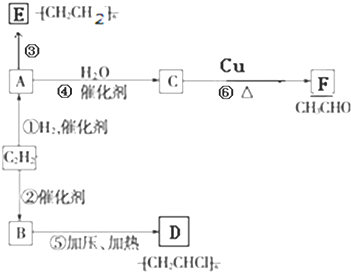
题目内容
11.在100mLH2SO4和K2SO4的混合溶液中,H2SO4的物质的量浓度为0.64mol/L,K2SO4的物质的量浓度为0.80mol/L,欲使H2SO4的浓度变为2.0mol/L,K2SO4的浓度变为0.20mol/L,现用98%的浓硫酸(ρ=1.84g/cm3)和蒸馏水进行配制,试求需要取用浓硫酸的体积.
分析 先根据混合前后硫酸钾溶液的浓度变化计算出混合后溶液的体积,从而可计算出最终混合液中含有硫酸的物质的量,再根据混合前溶液中硫酸的物质的量可计算出浓硫酸提供的硫酸的物质的量,然后根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的浓度,最后根据V=$\frac{n}{c}$计算出需要浓硫酸的体积.
解答 解:K2SO4的物质的量浓度从0.80mol/L变为0.20mol/L,则反应后溶液体积变为:$\frac{0.8mol/L×0.1L}{0.2mol/L}$=0.4L,
混合液中H2SO4的浓度变为2.0mol/L,则混合液中含有硫酸的物质的量为:2.0mol/L×0.4L=0.8mol,
原溶液中含有硫酸的物质的量为:0.64mol/L×0.1L=0.064mol,则加入的浓硫酸中提供的硫酸的物质的量为:0.8mol-0.064mol=0.736mol,
98%的浓硫酸(ρ=1.84g/cm3)的物质的量浓度为:$\frac{1000×1.84×98%}{98}$=18.4mol/L,
所以需要改浓硫酸的体积为:$\frac{0.736mol}{18.4mol/L}$=0.04L=40mL,
答:配制该溶液需要取用浓硫酸的体积为40mL.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确最终混合液体积为解答关键,注意掌握物质的量浓度的计算方法,试题有利于培养学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.在${\;}_{20}^{40}$Ca,${\;}_{19}^{39}$K,${\;}_{17}^{37}$Cl,${\;}_{18}^{38}$Ar四种微粒中,具有相同的( )
| A. | 中子数 | B. | 电子数 | C. | 质子数 | D. | 质量数 |
6.已知C2H5OH的质量分数为10%的乙醇溶液的密度是0.982g•cm-3,则该酒精溶液中乙醇的物质的量浓度是( )
| A. | 9.82mol•L-1 | B. | 4.91mol•L-1 | C. | 2.13mol•L-1 | D. | 1.12mol•L-1 |
9.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:下列叙述错误的是( )
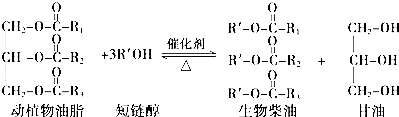
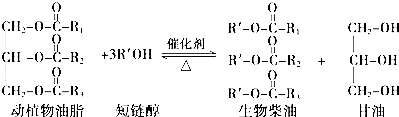
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 动植物油脂与醇的反应是皂化反应 |
6.下表对某些反应方程式的评价合理的是( )
| 编号 | 离子方程式或电极方程式 | 评价 | |
| A | Ca(ClO)2溶液中通入足量SO2 | Ca2++ClO-+SO2+H2O=CaSO4+Cl-+2H+ | 正确 |
| B | Ba(OH)2溶液中加入过量Al2(SO4)3溶液 | 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4+?CH3COOH+NH3•H2O | 错误,阴阳离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解 CuCl2和NaCl的混合溶液一段时间 | 阴极:Cu2++2e-=Cu 阳极:4OH--4e-=2H2O+O2 | 错误,只因为两级得失电子没配平 |
| A. | A | B. | B | C. | C | D. | D |
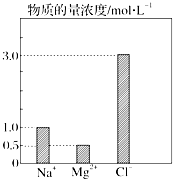 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题: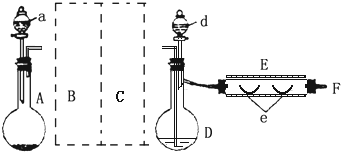 实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)
实验室制溴化亚铁可以用图示的装置:装置中A为CO2发生装置;D和d中均盛有液溴;E为外套电炉丝的不锈钢管;e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,随反应的进行将d中液溴滴入到D中.经过几个小时的连续反应,在钢管的一端沉积有80g黄绿色鳞片状溴化亚铁.(溴的沸点:58.78℃,并对有机物有腐蚀性)