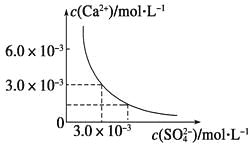
题目内容
【题目】为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
A.配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1,则可证明醋酸是弱电解质
C.取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸
【答案】C
【解析】
A.配制0.10 mol/LCH3 COOH溶液,测溶液的pH,若pH大于1,氢离子浓度小于醋酸浓度,说明醋酸部分电离,则可证明醋酸为弱电解质,A正确;
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1说明醋酸存在电离平衡,则可证明醋酸是弱电解质,B正确;
C.取等体积等浓度的CH3 COOH和盐酸溶液,分别加入![]() 固体,若醋酸溶液产生气体多,则醋酸中加入碳酸钠的量多,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,C错误;
固体,若醋酸溶液产生气体多,则醋酸中加入碳酸钠的量多,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,C错误;
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸,说明盐酸中氢离子浓度大于醋酸,则醋酸的电离程度小于盐酸,HCl是强电解质,则醋酸是弱电解质,D正确;
故答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
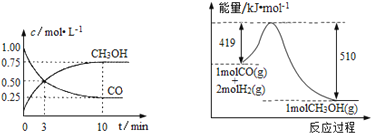
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量