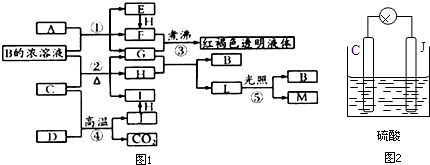
题目内容
2.下列关于各图象的解释或得出结论正确的是( )| A. | 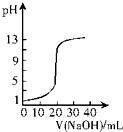 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 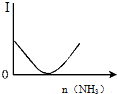 如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 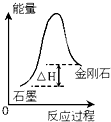 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 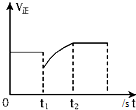 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |
分析 A、醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵是盐完全电离,导电性增强;
C、物质能量越高越活泼,由图象可知金刚石能量比石墨能量高;
D、t1时刻只减小的SO3的浓度,此时正反应速率在原平衡点,随反应进行减小.
解答 解:A、由图象可知曲线起始点pH=1,醋酸为弱酸,0.1000mol/L的醋酸溶液pH应大于1,故A错误;
B、乙酸是弱电解质,随通入氨气发生反应生成醋酸铵,CH3COOH+NH3=CH3COONH4,CH3COONH4是盐,水溶液中完全电离,溶液导电性应先增强,图象中导电性减弱,故B错误;
C、物质能量越高越活泼,图象中金刚石能量比石墨能量高,石墨转化为金刚石是吸热反应,所以石墨比金刚石稳定,故C正确;
D、t1时刻只减小的SO3的浓度,此时逆反应速率突然减小,而此时正反应速率应在原平衡点,然后随反应进行减小,故D错误;
故选C.
点评 本题考查了化学图象的分析判断,主要是弱电解质电离平衡,溶液导电性强弱判断,化学平衡影响因素分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
16.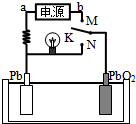 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
7.有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、Ba2+、MnO4-中的几种.为确定其成分,进行如下实验:
①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
14.下列各离子组在溶液中能大量共存且通入括号中相应气体后,仍能大量共存的是( )
| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
 +2H2O.
+2H2O.

 金属作为一种能源受到越来越多的关注.
金属作为一种能源受到越来越多的关注.