题目内容
16.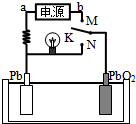 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-═2PbSO4+2H2O.下列有关说法正确的是( )| A. | K与N相接时,能量由化学能转化为电能 | |
| B. | K与N相接时,H+向负极区迁移 | |
| C. | K与M连接时,所用电源的a极为负极 | |
| D. | K与M相接时,阳极附近的pH逐渐增大 |
分析 A.K与N相接时,该装置是原电池,将化学能转化为电能;
B.K与N相接时,该装置是原电池,Pb作负极、PbO2作正极,电解质溶液中阳离子向正极移动;
C.K与M连接时,该装置是电解池,要使电极材料恢复原状,则Pb作阴极、PbO2作阳极,连接阴极的电极是负极、连接阳极的电极是正极;
D.K与M相接时,阳极电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,氢离子浓度增大.
解答 解:A.K与N相接时,该装置是原电池,将化学能转化为电能,有电流产生,故A正确;
B.K与N相接时,该装置是原电池,Pb作负极、PbO2作正极,电解质溶液中阳离子向正极移动,所以H+向正极区迁移,故B错误;
C.K与M连接时,该装置是电解池,要使电极材料恢复原状,则Pb作阴极、PbO2作阳极,连接阴极的电极是负极、连接阳极的电极是正极,则a是负极,故C正确;
D.K与M相接时,阳极电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,氢离子浓度增大,则溶液的pH减小,故D错误;
故选AC.
点评 本题考查常见化学电源及其工作原理,为高频考点,侧重考查原电池概念、离子移动方向、电极反应等知识点,明确各个电极上发生的反应是解本题关键,离子移动方向判断是易错点,难点是电极反应式的书写.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
6. 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | W点表示溶液中:c(NH4+)+c(H+)=c(OH-) | |
| B. | pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| C. | pH=9.5溶液中:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
7.下列离子方程式书写正确的是( )
| A. | 用石灰乳吸收氯气:2Cl2+2OH-=2Cl-+2ClO-+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+=4Cr3++11H2O+3CH3COO- | |
| D. | 碳酸氢铵与足量的氢氧化钙溶液反应:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32- |
4.下列说法正确的是( )
| A. | 常温下,pH=1的溶液中还可以大量存在:K+、MnO4-、SO42-、CH3CHO | |
| B. | 含有较多Fe3+的溶液中还可以大量存在:Na+、SO42-、SCN-、CO32- | |
| C. | 碳酸氢钙溶液与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
11.下列说法正确的是( )
| A. | 淀粉、油脂、氨基酸都能水解,但水解产物不同 | |
| B. | SO2具有氧化性,因此可用于漂白纸浆 | |
| C. | 植物油和裂化汽油都能使溴水褪色 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
1.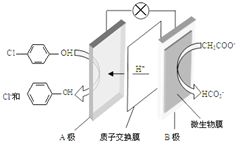 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(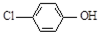 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| B. | A极的电极反应式为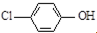 +e-═Cl-+ +e-═Cl-+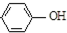 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
8.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
1.“三酸二碱”在化工生产中有着重要的应用.下列说法正确的是( )
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 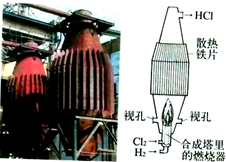 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
2.下列关于各图象的解释或得出结论正确的是( )
| A. | 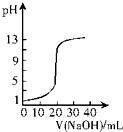 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 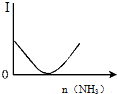 如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 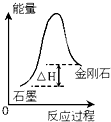 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 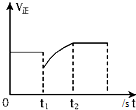 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |