题目内容
7.电子数相等的粒子叫做等电子体,下列各组粒子属于等电子体是( )| A. | NO和NO2 | B. | CO和CO2 | C. | CO2和SO2 | D. | CH4和NH3 |
分析 根据题目信息,电子数目相同的微粒为等电子体,据此结合选项判断.
解答 解:A、NO分子含有电子数为15,NO2的电子数为23,二者电子数目不相等,不是等电子体,故A错误;
B、CO分子含有电子数为14,CO2的电子数为22,二者电子数目不相等,不是等电子体,故B错误;
C、CO2分子含有电子数为22,SO2的电子数为32,二者电子数目不相等,不是等电子体,故C错误;
D、CH4分子含有电子数为10,NH3的电子数为10,二者电子数目相等,是等电子体,故D正确;
故选D.
点评 本题考查等电子体、学生对信息的理解与直接运用,比较基础,注意基础知识的掌握.

练习册系列答案
相关题目
17.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ.mo1-1 | |
| B. | 反应①的反应热为221 kJ.mo1-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成l mo1水时放出57.3 kJ的热量 |
2.下列化学名词或名称正确的是( )
| A. | 石炭酸 | B. | 三溴笨酚 | C. | 脂基 | D. | 2-甲基丁烷 |
12.下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
元素周期表
(1)这些元素中非金属性最强的单质是F2,最高价氧化物对应水化物酸性最强的是HClO4,最高价氧化物对应水化物碱性最强是NaOH.
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
元素周期表
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
(2)表中K的氢化物的化学式为HCl,它的还原性比j的氢化物还原性弱(填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性强(填“强”或“弱”).
(3)e单质为N2,其结构式为N≡N.
(4)写出i的氧化物与强碱反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
19.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 以乙烯为原料制备二氯乙烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
16.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)F元素在周期表中的位置是第三周期第ⅢA族.
(2)分别写出BA4、EG的电子式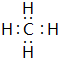 、
、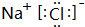
(3)用电子式表示离子化合物E2D、BD2的形成过程: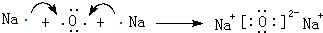 、
、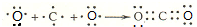
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
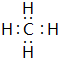 、
、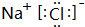
(3)用电子式表示离子化合物E2D、BD2的形成过程:
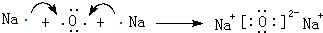 、
、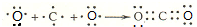
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
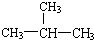
 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题: