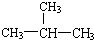题目内容
8. 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为[Ar]3d9.
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为4,离子的空间构型是正四面体.
(3)液氨分子间存在自耦电离:2NH3?NH2-+NH4+,NH2-中氮原子轨道的杂化类型是sp3,H+易与NH3形成NH4+,配位键的解释是NH3分子中的氮原子有一对孤对电子,易与H+通过配位键形成[NH4]+.
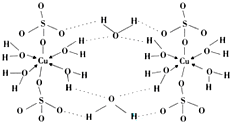
(4)胆矾CuSO4•5H2O的结构示意图如图,其含有的微粒间作用力有abde.(填序号)
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为4,1mol CN-中含有的π键的数目为2NA.
分析 (1)Cu为29号元素,其原子核外有29个电子,Cu原子失去最外层电子生成Cu2+,据此书写Cu2+核外电子排布式;
(2)根据价层电子对互斥理论判断PO43-离子内中心原子价层电子对个数及空间构型;
(3)根据价层电子对互斥理论判断中心原子杂化方式;含有空轨道和含有孤电子对的原子之间易形成配位键;
(4)该微粒中含有配位键、极性键、氢键、离子键;
(5)配合物[Cu(CN)4]2-,Cu2+的配位数为4,CN-与N2为等电子体,等电子体结构相似,所以一个CN-中含有两个π键.
解答 解:(1)Cu为29号元素,其原子核外有29个电子,Cu原子失去最外层电子生成Cu2+,Cu2+核外电子排布式为[Ar]3d9,故答案为:[Ar]3d9;
(2)PO43-离子内中心原子价层成键电子对为4、孤电子对数为0,所以PO43-离子内中心原子价层成键电子对和孤电子对之和为4,离子的空间构型是正四面体,
故答案为:4;正四面体;
(3)NH2-中N原子价层电子对数为4且含有两个孤电子对,所以N原子采用sp3杂化;NH3分子中的氮原子有一对孤对电子,易与H+通过配位键形成[NH4]+;
故答案为:sp3;NH3分子中的氮原子有一对孤对电子,易与H+通过配位键形成[NH4]+;
(4)该微粒中硫酸根离子和铜离子形成离子键、Cu原子和O原子之间形成配位键、S-O及O-H原子之间形成极性键,水分子之间还能形成氢键,故选abde;
(5)配合物[Cu(CN)4]2-,Cu2+的配位数为4,CN-与N2为等电子体,等电子体结构相似,所以一个CN-中含有两个π键,所以1mol CN-中含有的π键的数目为2NA,
故答案为:4;2NA.
点评 本题考查物质结构和性质,涉及配合物、化学键、原子杂化、微粒空间构型、原子核外电子排布等知识点,这些都是高频考点,难点是价层电子对互斥理论内涵,注意配合物內界和外界的区分,题目难度不大.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 以乙烯为原料制备二氯乙烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
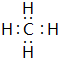 、
、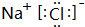
(3)用电子式表示离子化合物E2D、BD2的形成过程:
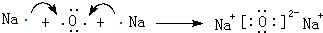 、
、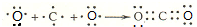
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
| A. | 核外电子排布相同的微粒,其化学性质也相同 | |
| B. | 含有金属元素和非金属元素的化合物不一定是离子化合物 | |
| C. | 仅含非金属元素的化合物一定是共价化合物 | |
| D. | 凡需要加热的反应一定是吸热反应 |
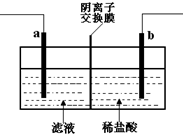 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
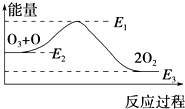 氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.
氯原子对O3的分解有催化作用:O3+Cl═ClO+O2△H1,ClO+O═Cl+O2△H2.大气臭氧层的分解反应是:O3+O═2O2△H,该反应的能量变化如图所示,则下列叙述正确的是( )
| A. | 反应O3+O═2O2的△H=E1-E3 | B. | 反应O3+O═2O2是吸热反应 | ||
| C. | △H=△H1+△H2 | D. | 氯原子没有改变O3分解反应的历程 |