题目内容
16.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| B. | 某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| D. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A、根据钠元素与A元素的所有存在形式之比为1:1分析解答;
B、NaHY的水溶液显碱性,说明水解程度大于电离程度,不水解的钠离子的浓度最大;
C、物质的量浓度相等的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH)=2c(Na+);
D、pH=12的氨水和pH=2的盐酸等体积混合,得到氨水和氯化铵的混合溶液,溶液呈碱性以氨水的电离为主,由此分析解答.
解答 解:A、根据钠元素与A元素的所有存在形式之比为1:1,所以离子浓度c(Na+)=c(A2-)+c(HA-)+c(H2A),故A错误;
B、NaHY的水溶液显碱性,说明水解程度大于电离程度,不水解的钠离子的浓度最大,所以离子浓度大小为c(Na+)>c(HY-)>c(OH-)>c(H+),故B正确;
C、物质的量浓度均相等的CH3COONa和CH3COOH溶液等体积混合,溶液显酸性,电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(CH3COO-)+c(CH3COOH=2c(Na+),由上述两个式子可得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C错误;
D、pH=12的氨水和pH=2的盐酸等体积混合,得到氨水和氯化铵的混合溶液,溶液呈碱性以氨水的电离为主,所以离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,侧重于学生的分析能力的考查,注意把握电荷守恒、物料守恒的运用,难度不大.

练习册系列答案
相关题目
6.下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
7.在加热固体NH4Al(SO4)2•12H2O时,固体质量随温度的变化曲线如图所示:已知A点物质为NH4Al(SO4)2,B点物质为Al2(SO4) 3,下列判断正确的是( )
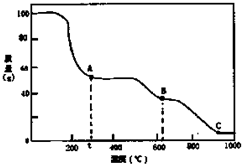

| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
1.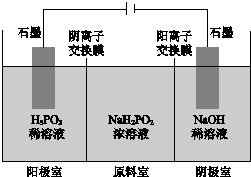 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
 次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解
次磷酸(H3PO2)是一元弱酸,工业可用如图所示装置电解NaH2PO2制H3PO2.(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)下列说法正确的是( )
| A. | 阳极室有H2生成 | B. | 阴极室溶液pH减小 | ||
| C. | 原料室溶液pH保持不变 | D. | 阳极室可能有H3PO4生成 |
8.下列4组原子序数的元素,彼此间能形成共价键的是( )
| A. | 8和11 | B. | 8和12 | C. | 15和17 | D. | 12和16 |
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |