题目内容
17.我国硫酸型酸雨危害十分严重,形成硫酸型酸雨主要是由于空气中二氧化硫含量超标.(1)大气中SO2主要有三个硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
放置时,雨水样品pH变小的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强(写化学方程式)
(3)为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,请写出反应离子方程式SO2+2OH-═SO32-+H2O.
分析 (1)大气中产生二氧化硫的途径主要有三个:硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧;
(2)雨形成的主要原因是大量燃烧化石燃料,产生二氧化硫,随雨降落形成,酸雨放置时,发生的反应为:2H2SO3+O2=2H2SO4,由弱酸生成强酸,酸性增强;
(3)煤中含有S,与氧气反应生成SO2,SO2与CaO反应生成CaSO3,进一步反应生成CaSO4,以此解答该题;
(4)氢氧化钠与二氧化硫反应生成亚硫酸钠和水.
解答 解:(1)硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧,是大气中产生二氧化硫的主要途径,
故答案为:化石燃料的燃烧;
(2)酸雨形成的主要原因是:大量燃烧化石燃料(煤和石油等),产生二氧化硫,随雨降落形成,酸雨样品放置,发生的反应为:2H2SO3+O2=2H2SO4,酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强,
故答案为:酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强;
(3)煤中含有S,与氧气反应生成SO2,反应方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,SO2与CaO反应生成CaSO3,反应方程式为CaO+SO2═CaSO3,进一步反应生成CaSO4,反应方程式为2CaSO3+O2═2CaSO4,
故答案为:CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4;
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,反应的离子方程式为:SO2+2OH-═SO32-+H2O,故答案为:SO2+2OH-═SO32-+H2O.
点评 本题考查二氧化硫的污染及治理,侧重于基础知识的考查,题目难度不大,注意把握二氧化硫的性质,为解答该题的关键,该题有利于培养学生的良好的科学素养,提高学生学习的积极性.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案| A. | 铝片和稀硫酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与二氧化碳反应 | D. | 甲烷在氧气中燃烧 |
| A. | 0.1mol•L-1 | B. | 0.15mol•L-1 | C. | 0.2mol•L-1 | D. | 0.25mol•L-1 |
| A. | N2O | B. | NO | C. | NH4NO3 | D. | N2 |
| A. | $\frac{71}{161}$×100% | B. | $\frac{w}{w+36a}$×100% | ||
| C. | $\frac{7100w}{161(w+18a)}$% | D. | $\frac{71w}{161(w+36a)}$×100% |
| A. | 加聚反应也可能有水生成 | |
| B. | 水、乙醇、氢氧化钠中都存在羟基 | |
| C. | 王水、溴水、水银、水晶中均含有“H2O” | |
| D. | 在某些有机反应中,水可能是反应物也可能是生成物 |
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
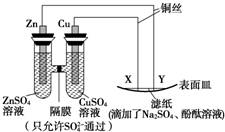
| A. | Y为负极,发生氧化反应 | B. | X为阴极,发生还原反应 | ||
| C. | Y与滤纸接触处变红 | D. | X与滤纸接触处有H2生成 |