题目内容
6.据最近报道,某放射性元素的原子钬16667Ho,可有效地治疗肝癌.该同位素原子核内中子数和核外电子数之差为( )| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
分析 根据原子符号左上角数字为质量数,左下角数字为质子数,中子数=质量数-质子数,原子中核外电子数=核内质子数,据此分析解答.
解答 解:16667Ho的质子数是67,质量数是166,中子数=质量数-质子数=166-67=99,原子中核外电子数=核内质子数=67,核内的中子数与核外的电子数之差为99-67=32,
故选A.
点评 本题考查原子中的数量关系,掌握原子中质子数、质量数、中子数和核外电子数之间的关系是解本题的关键,难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
16.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物的减小或任何一种生成物的增加 | |
| B. | 化学反应速率0.8mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
17.我国硫酸型酸雨危害十分严重,形成硫酸型酸雨主要是由于空气中二氧化硫含量超标.
(1)大气中SO2主要有三个硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
根据上述材料回答下列问题:
放置时,雨水样品pH变小的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强(写化学方程式)
(3)为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,请写出反应离子方程式SO2+2OH-═SO32-+H2O.
(1)大气中SO2主要有三个硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
放置时,雨水样品pH变小的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强(写化学方程式)
(3)为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,请写出反应离子方程式SO2+2OH-═SO32-+H2O.
1.下列离子方程式正确的是( )
| A. | 稀硫酸滴在铜片上Cu+2H+═Cu2++H2↑ | |
| B. | 氧化铜与硫酸混合Cu2++SO42--═CuSO4 | |
| C. | 硝酸滴在石灰石上CO32-+2H+═Ca2++H2O+CO2↑ | |
| D. | 硫酸钠溶液与氯化钡溶液混合Ba2++SO42-═BaSO4↓ |
11.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A. | 32g/mol | B. | 16g | C. | 32g | D. | 64g/mol |
18.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_2^3He$,而地球上氦元素主要以${\;}_2^4He$的形式存在.下列说法正确的是( )
| A. | ${\;}_2^3He$和${\;}_2^4He$互为同位素 | |
| B. | ${\;}_2^4He$原子核内含有4个质子 | |
| C. | ${\;}_2^3He$原子核内含有3个中子 | |
| D. | ${\;}_2^4He$的最外层电子数为2,所以${\;}_2^4He$具有较强的金属性 |
15.下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
| A. | 相同浓度溶液的碱性Na2CO3>NaHCO3 | |
| B. | 与同浓度的硫酸溶液反应放出气泡的速率NaHCO3<Na2CO3 | |
| C. | 在水中的溶解度Na2CO3>NaHCO3 | |
| D. | 热稳定性NaHCO3<Na2CO3 |
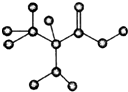 如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答:
如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答: