题目内容
5.有硫酸钾和硫酸铝的混合溶液,已知其中Al3+物质的量浓度为0.4mol•L-1,SO42-的物质的量浓度为0.7mol•L-1,则此溶液中K+的物质的量浓度为( )| A. | 0.1mol•L-1 | B. | 0.15mol•L-1 | C. | 0.2mol•L-1 | D. | 0.25mol•L-1 |
分析 根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此结合题中数据进行解答.
解答 解:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则:3c(Al3+)+c(K+)=2c(SO42-),
则:3×0.4mol/L+c(K+)=2×0.7mol/L,
所以溶液中钾离子浓度为:c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.
点评 本题考查混合溶液中离子浓度的计算,题目难度中等,注意掌握电荷守恒在化学计算中的应用方法,明确物质的量浓度的概念及表达式为解答关键.

练习册系列答案
相关题目
16.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物的减小或任何一种生成物的增加 | |
| B. | 化学反应速率0.8mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |
20.同温、同压下将H2、O2、Cl2按9:4:1的体积比混合,在密闭容器中用电火花引燃,充分反应后,将产物冷却到室温,所得溶液的质量分数为( )
| A. | 48.2% | B. | 33.6% | C. | 29.4% | D. | 无法计算 |
10.空气质量报告中不涉及的是( )
| A. | SO2 | B. | CO2 | C. | NO2 | D. | 可吸入颗粒 |
17.我国硫酸型酸雨危害十分严重,形成硫酸型酸雨主要是由于空气中二氧化硫含量超标.
(1)大气中SO2主要有三个硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
根据上述材料回答下列问题:
放置时,雨水样品pH变小的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强(写化学方程式)
(3)为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,请写出反应离子方程式SO2+2OH-═SO32-+H2O.
(1)大气中SO2主要有三个硫酸厂的尾气、含硫物的冶炼和化石燃料的燃烧
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
放置时,雨水样品pH变小的主要原因酸雨样品中的H2SO3逐渐被氧化成H2SO4,使溶液的酸性增强(写化学方程式)
(3)为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”反应的化学方程式CaO+SO2═CaSO3、2CaSO3+O2═2CaSO4
(4)实验室制取SO2,通常采用NaOH溶液进行尾气吸收,请写出反应离子方程式SO2+2OH-═SO32-+H2O.
15.下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
| A. | 相同浓度溶液的碱性Na2CO3>NaHCO3 | |
| B. | 与同浓度的硫酸溶液反应放出气泡的速率NaHCO3<Na2CO3 | |
| C. | 在水中的溶解度Na2CO3>NaHCO3 | |
| D. | 热稳定性NaHCO3<Na2CO3 |

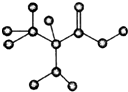 如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答:
如图是某有机物的球棍模型,该物质只含C、H、O、N四种元素,请回答: