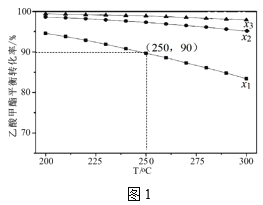
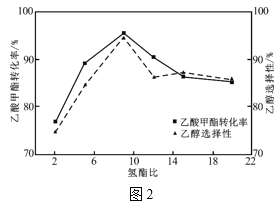
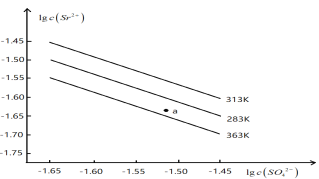
题目内容
【题目】化学与人类生活密切相关。请按要求回答下列问题:
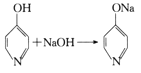
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 +3Cl2 +10KOH![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有0.5mol K2FeO4生成时,消耗Cl2在标况下的体积为_________,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式__________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:_____________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
【答案】Fe(OH)3 16.8L 1.5NA或9.03×1023 2Na2O2+2CO2=2Na2CO3+O2 NaHCO3=Na++HCO3- 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2HClO![]() 2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
【解析】
(1)还原剂是失去电子,化合价升高的微粒,根据反应方程式,Fe的化合价由+3价→+6价,化合价升高,即还原剂为Fe(OH)3,根据反应方程式,因此有![]() ,解得n(Cl2)=0.75mol,标准状况下,消耗氯气的体积为0.75mol×22.4L·mol-1=16.8L;转移电子物质的量为0.5mol×(6-3)=1.5mol,即转移电子数为1.5NA或9.03×1023;
,解得n(Cl2)=0.75mol,标准状况下,消耗氯气的体积为0.75mol×22.4L·mol-1=16.8L;转移电子物质的量为0.5mol×(6-3)=1.5mol,即转移电子数为1.5NA或9.03×1023;
(2)过氧化钠与CO2的反应:2Na2O2+2CO2=2Na2CO3+O2;
(3)小苏打是NaHCO3,在水中电离方程式为NaHCO3=Na++HCO3-;
(4)工业上制取漂白粉是将Cl2通入石灰乳中,即反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;新制氯水中有Cl2+H2O=HCl+HClO,HClO见光分解,2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(5)FeCl3与Cu的反应:2Fe3++Cu=Cu2++2Fe2+;铁比铜活泼,先发生Fe+2Fe3+=3Fe2+,如果FeCl3溶液过量,则Cu与FeCl3发生Cu+2Fe3+=2Fe2++Cu2+,
A、根据上述分析,如果Cu过量,则剩余固体中可能会有铜无铁,故A不符合题意;
B、根据上述分析,铁先参与反应,若FeCl3过量,Cu再参与反应,因此不可能出现有铁无铜的结果,故B符合题意;
C、根据上述分析,假如铁过量,则会出现,铁和铜同时存在的结果,故C不符合题意;
D、假如FeCl3溶液,将Fe和Cu全部消耗,即铜和铁均无剩余,故D不符合题意;
答案为B。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
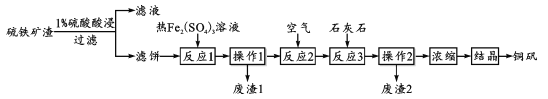
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。