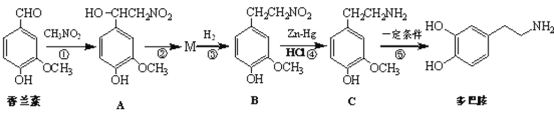
题目内容
【题目】在相同的密闭容器中,不同温度下发生反应:2A(g)![]() 2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
2B(g)+C(g) ΔH>0,气体A的浓度随时间t变化如下表所示。
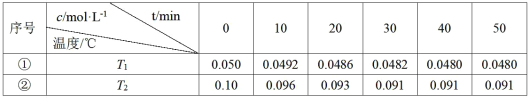
下列说法不正确的是( )
A.实验的温度:T2>T1
B.实验①前20min的平均反应速率v(C)=3.5×10-5molL-1min-1
C.实验②比实验①提前10min达到平衡
D.实验②中A的平衡转化率为9%
【答案】C
【解析】
A. 在相同的密闭容器中,根据反应,实验①中,A平衡是浓度为0.048mol/L,B平衡浓度为0.002mol/L,C平衡浓度为0.001mol/L,平衡常数=![]() 。同理,实验②中A平衡是浓度为0.091mol/L,B平衡浓度为0.009mol/L,C平衡浓度为0.00045mol/L,平衡常数=
。同理,实验②中A平衡是浓度为0.091mol/L,B平衡浓度为0.009mol/L,C平衡浓度为0.00045mol/L,平衡常数=![]() ,由于反应为吸热反应,温度越高,平衡正向进行的程度越大,平衡常数越大,故实验的温度T2>T1,由化学反应速率的大小关系也可以得到这个结论,A正确;
,由于反应为吸热反应,温度越高,平衡正向进行的程度越大,平衡常数越大,故实验的温度T2>T1,由化学反应速率的大小关系也可以得到这个结论,A正确;
B. 实验①前20min的平均反应速率![]() ,B正确;
,B正确;
C. 实验②在30min时已平衡,实验①在40min时已平衡,但是由于记数间隔是10min,无法判断具体的平衡时间, C不正确;
D. 实验②中,平衡是A的浓度为0.091mol/L,平衡转化量=0.091 mol/L -0.10 mol/L =0.009 mol/L ,![]() ,D正确。
,D正确。
本题选不正确的,故答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目