题目内容
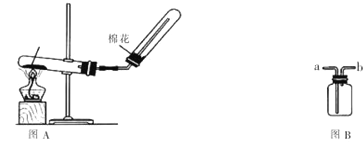
【题目】铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:
(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______。
(3)“反应2”中通入空气的目的是_______;结合离子方程式,说明“反应3”加入石灰石的作用________。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____;分析下列溶解度信息,最适宜的结晶方式为_________。
t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____。
【答案】提高对固体矿渣的浸取率 Cu+2Fe3+=2Fe2++Cu2+ 1:2 将Fe2+氧化为Fe3+ Fe3++3H2OFe(OH)+3H+,加入CaCO3消耗H+,使上述反应正向移动,有利于Fe(OH)3沉淀 将滤液并入 降温结晶 4
【解析】
硫铁矿渣加1%稀硫酸进行酸浸,CuSO3、Cu2O分别与稀硫酸反应,CuSO3+H2SO4=CuSO4+SO2↑+H2O、Cu2O+H2SO4=CuSO4+Cu+H2O,过滤后滤液中含有CuSO4,滤饼中有难溶于酸的Cu2S、CuS和酸浸时生成的Cu,加入热Fe2(SO4)3发生氧化还原反应,反应后铜变为Cu2+、硫离子被氧化为硫单质经过滤除去,Fe3+被还原为Fe2+,通入空气将Fe2+氧化为Fe3+,然后加入石灰石调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀过滤除去,将滤液与第一次过滤后的滤液混合,蒸发浓缩,冷却结晶,得到铜矾,根据以上分析解答。
(1)“1%硫酸酸浸”时,由于硫酸浓度较小,为了提高固体矿渣的浸取率,可增加硫酸的体积和浸取的次数,故采取固液质量比为1:3并进行4~6次浸取的工艺,答案为:为了提高固体矿渣的浸取率。
(2)滤饼中的Cu可以与热Fe2(SO4)3发生氧化还原反应,Fe3+被还原为Fe2+,Cu被氧化为Cu2+,根据得失电子守恒、电荷花守恒,该反应的离子方程式为:Cu+2Fe3+=2Fe2++Cu2+;“废渣1”中只含有S单质,“反应1”中Cu2S与Fe2(SO4)3反应时,Cu由+1价变为+2价,S由-2价变为0价,Fe由+3价变为+2价,1molCu2S共失去12+2=4mol电子,1mol Fe2(SO4)3得到12=2 mol电子,根据得失电子守恒可知,Cu2S与Fe2(SO4)3反应时的物质的量之比为1:2,答案为:Cu+2Fe3+=2Fe2++Cu2+;1:2;
(3)在化工生产中,通常先把Fe2+氧化为Fe3+,然后再调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀除去,所以“反应2”中通入空气的目的是将Fe2+氧化为Fe3+,由于Fe3+ 发生水解反应Fe3++3H2OFe(OH)+3H+ ,“反应3”加入CaCO3消耗H+,使上述反应正向移动,有利于Fe(OH)3沉淀生成,答案为:将Fe2+氧化为Fe3+;加入CaCO3消耗H+,使上述反应正向移动,有利于Fe(OH)3沉淀;
(4)由分析可知酸浸后过滤得到的滤液中含有一定量的CuSO4,为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前将此滤液并入,由表中数据可知,铜矾的溶解度随温度的升高而增大,因此可对滤液进行蒸发浓缩、降温结晶,从而得到铜矾晶体,答案为:将滤液并入;降温结晶;
(5)将铜矾、生石灰的质量比1.0:0.56,其物质的量之比=![]() :
:![]() =2:5,根据原子守恒可知Cu2+离子和Ca2+离子的物质的量之比为2:5,将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,硫酸铜和氢氧化钙反应生成氢氧化铜和硫酸钙的方程式为:CuSO4+Ca(OH)2=Cu(OH)2+CaSO4,波尔多液有效成分为CuSO4·xCu(OH)2·
=2:5,根据原子守恒可知Cu2+离子和Ca2+离子的物质的量之比为2:5,将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,硫酸铜和氢氧化钙反应生成氢氧化铜和硫酸钙的方程式为:CuSO4+Ca(OH)2=Cu(OH)2+CaSO4,波尔多液有效成分为CuSO4·xCu(OH)2·

【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,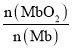 =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。
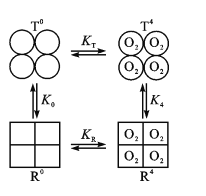
①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。