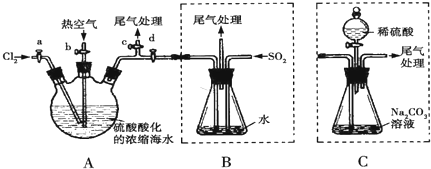
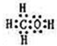题目内容
7.下列事实能用同一原理解释的是( )| A. | 溴乙烷、乙酸都能与NaOH水溶液反应 | |
| B. | 乙酸乙酯、乙酸钠都能与稀硫酸反应 | |
| C. | 福尔马林、葡萄糖与新制Cu(OH)2共热都有红色沉淀生成 | |
| D. | 乙烯、乙醛都能使溴水褪色 |
分析 A.溴乙烷与NaOH发生水解反应,而乙酸与NaOH发生中和反应;
B.乙酸乙酯在酸性条件下水解,而乙酸钠与硫酸发生强酸制取弱酸的反应;
C.福尔马林、葡萄糖均含-CHO,易被氧化;
D.乙烯与溴水发生加成反应,乙醛能被溴水氧化.
解答 解:A.溴乙烷与NaOH发生水解反应,而乙酸与NaOH发生中和反应,分别为水解反应、中和反应,原理不同,故A错误;
B.乙酸乙酯在酸性条件下水解,而乙酸钠与硫酸发生强酸制取弱酸的反应,分别为水解反应、复分解反应,原理不同,故B错误;
C.福尔马林、葡萄糖均含-CHO,均能被新制Cu(OH)2氧化,共热时生成砖红色Cu2O沉淀,原理相同,故C正确;
D.乙烯与溴水发生加成反应,乙醛能被溴水氧化,均使溴水褪色,分别发生加成反应、氧化反应,原理不同,故D错误;故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及反应类型的考查,注意选项B中强酸制弱酸的原理为易错点,题目难度不大.

练习册系列答案
相关题目
18.已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )
| A. | 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 | |
| D. | 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
12.为证明溴乙烷在NaOH的乙醇溶液中加热发生消去反应,可将反应后的气体通入( )
| A. | 溴水 | B. | AgNO3溶液 | C. | 酸性KMnO4溶液 | D. | 酸化的AgNO3溶液 |
16.家里的食用花生油中如果混有水份,可以采用下列何种方法分离( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
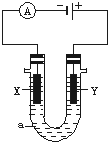 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: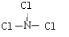 ;由A、B、D三种元素组成的18电子微粒的电子式为
;由A、B、D三种元素组成的18电子微粒的电子式为