题目内容
【题目】ClO2是高效、广谱、绿色的消毒剂,回答下列问题。
(1)氯在元素周期表中的位置是_______________,1mol 37Cl的中子数为_______________。
(2)下列能判断Cl和O两种元素非金属性强弱的是____________ (填序号) 。
a.原子得电子能力 b.与金属钠反应得电子的数目c.气态氢化物的稳定性 d.单质的沸点
(3)生产生活中含氯物质的排放会加快臭氧层的破坏,其机理如图所示,该机理的总反应化学方程式为_______________。
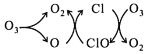
(4)化工、冶金行业的废水中存在CN—,可用ClO2气体将其转化为两种无毒气体
①CN—的电子式为_______________。
②该反应的离子方程式为_______________。
【答案】第三周期ⅤⅡA族 1.204×1025个 ac 2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2
3O2 ![]() 2CN+2ClO2=2CO2+N2+2Cl
2CN+2ClO2=2CO2+N2+2Cl
【解析】
(1)Cl的质子数为17,原子结构中含3个电子层、最外层电子数为7,37Cl的中子数为37-17=20;
(2)由得电子能力及气态氢化物的稳定性等来比较非金属性;
(3)由图可知O3转化为O2;
(4)①CN-中含C≡N;
②发生氧化还原反应生成氮气、二氧化碳和氯离子。
(1)氯在元素周期表中的位置是第三周期ⅤⅡA族;1mol37Cl的中子数为1mol×(37-17)×6.02×1023=1.204×1025个,
故答案为:第三周期ⅤⅡA族;1.204×1025个;
(2)由得电子能力及气态氢化物的稳定性等来比较非金属性,只有ac符合,与得电子多少、单质的沸点无关,
故答案为:ac;
(3)由图可知O3转化为O2,总反应化学方程式为2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2,
3O2,
故答案为:2O3 ![]() 3O2或2O3
3O2或2O3![]() 3O2;
3O2;
(4)①CN一中碳氮之间为三键,电子式为![]() 。
。
故答案为:![]() ;
;
②ClO2氧化性较强,是常用的氧化剂,其中+4价氯元素通常被还原为1价,在该反应中而CN中+2价碳元素通常被氧化成+4价,而氮元素则容易被氧化成0价形成氮气,由电子、电荷可知离子反应为2CN+2ClO2=2CO2+N2+2Cl,
故答案为:2CN+2ClO2=2CO2+N2+2Cl。