题目内容
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
【答案】 ![]() +Br2
+Br2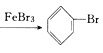 +HBr AgNO3+HBr=AgBr↓+HNO3 导出HBr,兼起冷凝器的作用 旋转分液漏斗的活塞 使溴和苯的混合液滴到铁粉上 托起软橡胶袋使铁粉落入溴和苯的混合液中 Br2和苯的蒸气逸出,污染环境 吸收反应中随HBr逸出的溴蒸气和苯蒸气 CCl4由无色变成橙色 随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低 由于导管插入AgNO3溶液中而易产生倒吸
+HBr AgNO3+HBr=AgBr↓+HNO3 导出HBr,兼起冷凝器的作用 旋转分液漏斗的活塞 使溴和苯的混合液滴到铁粉上 托起软橡胶袋使铁粉落入溴和苯的混合液中 Br2和苯的蒸气逸出,污染环境 吸收反应中随HBr逸出的溴蒸气和苯蒸气 CCl4由无色变成橙色 随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低 由于导管插入AgNO3溶液中而易产生倒吸
【解析】实验室制溴苯所用的试剂有液溴和苯,铁粉作催化剂(实际起催化作用的是溴化铁),该反应是一个放热反应,由于反应物苯和溴都是易挥发的液体,所以生成的溴化氢气体中必然会混有苯和溴的蒸气。为了解决这一问题,我们一般要采用冷凝回流装置将苯和溴的蒸气冷凝回流到反应器中,同时也提高了原料的利用率。当然,如果没有冷凝回流装置,也可以根据相似相溶原理用四氯化碳等有机溶剂来吸收溴化氢中的溴蒸气和苯,防止其干扰对溴化氢的检验。溴化氢类似于氯化氢也是极易溶于水的气体,故不能将溴化氢气体直接通入水中以防倒吸。本实验的尾气中含有毒气体,应有尾气处理装置,以防尾气污染空气。
(1). 三个装置中发生反应的主要化学方程式:![]() +Br2
+Br2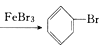 +HBr。B中右边试管用于检验生成的溴化氢气体,所发生反应的化学方程式:AgNO3+HBr=AgBr↓+HNO3。
+HBr。B中右边试管用于检验生成的溴化氢气体,所发生反应的化学方程式:AgNO3+HBr=AgBr↓+HNO3。
(2). 装置A和C均采用了长玻璃导管,其作用是导出HBr、兼起冷凝器的作用。 (3). 在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是旋转分液漏斗的活塞使溴和苯的混合液滴到铁粉上;应对装置C进行的操作是托起软橡胶袋使铁粉落入溴和苯的混合液中。
(4). 装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是Br2和苯的蒸气逸出,污染环境。
(5). B中采用了洗气瓶吸收装置,其作用是吸收反应中随HBr逸出的溴蒸气和苯蒸气,反应后洗气瓶中可能出现的现象是CCl4由无色变成橙色。
(6). B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;由于导管插入AgNO3溶液中而易产生倒吸。

【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和 。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L NaOH溶液对20.00 mL醋酸溶液进行滴定(酚酞作指示剂),几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(ml) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 mol/L。(保留小数点后四位)
(3)判断滴定终点的方法是 。
(4)下列操作中可能使所测醋酸溶液的浓度数值偏低的是 (填字母序号)。
A.碱式滴定管未用标准液润洗就直接注入标准液
B.滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.量取醋酸体积时,开始俯视读数,滴定结束时仰视读数
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 |
(5)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是 。