题目内容
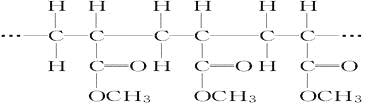
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
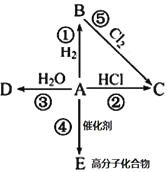
(1)写出A的电子式__________,E的结构简式为__________
(2)写出下列反应化学方程式,并注明③⑤反应类型
②_____________________________________________
③_____________________,反应类型________;
⑤_____________________,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为__________
【答案】
![]() CH2=CH2+HCl→CH3CH2Cl CH2=CH2+H2O
CH2=CH2+HCl→CH3CH2Cl CH2=CH2+H2O![]() CH3CH2OH 加成反应 CH3CH3+Cl2
CH3CH2OH 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl 取代反应 溴水
CH3CH2Cl+HCl 取代反应 溴水
【解析】
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,则烃A为乙烯;乙烯和氢气发生反应①生成有机物B,有机物B为乙烷;乙烯与氯化氢发生反应②生成有机物C,有机物C为氯乙烷;乙烯和水反应发生反应③生成有机物D,有机物D为乙醇;乙烯可以发生反应④生成高分子化合物E,E为聚乙烯;乙烷可以与氯气发生反应⑤生成氯乙烷,据此分析。
(1)根据分析,有机物A为乙烯,结构简式为CH2=CH2,电子式为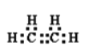 ;高分子化合物E为聚乙烯,聚乙烯的结构简式为
;高分子化合物E为聚乙烯,聚乙烯的结构简式为![]() ;
;
(2)反应②的化学方程式为CH2=CH2+HCl→CH3CH2Cl,反应类型为加成反应;
反应③的化学方程式为CH2=CH2+H2O![]() CH3CH2OH,反应类型为加成反应;
CH3CH2OH,反应类型为加成反应;
反应⑤的化学方程式为CH3CH3+Cl2![]() CH3CH2Cl+HCl,反应类型为取代反应;
CH3CH2Cl+HCl,反应类型为取代反应;
(3)乙烷中混有少量乙烯,可将混合气体通入到溴水中,乙烯与溴水反应生成1,2—二溴乙烷液体,而乙烷不与溴水反应。

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
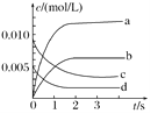
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变