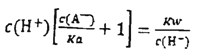��Ŀ����
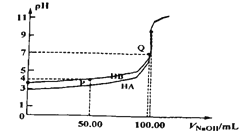
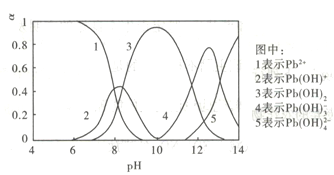
����Ŀ��ˮ�����ؽ���Ǧ����Ⱦ���ⱸ�ܹ�ע��������֪Pb4+���к�ǿ����������ˮ��Ǧ�Ĵ�����̬��Ҫ��Pb2+��Pb(OH)+��Pb(OH)2( ��ˮ���ܽ��С)��Pb(OH)3-��Pb(OH)42-������̬�����ʵ�������a����ҺpH�仯�Ĺ�ϵ����ͼ��ʾ:
�����й�˵����ȷ����
A. Pb(NO3)2��Һ��,c(Pb2+)/c(NO3-)=1/2
B. ��Pb(NO3)2���еμ��Ȼ����Һ,��Һ��c(Pb2+)/c(NO3-)��С��������Cl-��Pb2+������Ӧ
C. ��Pb(NO3)2��Һ�еμ�NaOH��Һ��pH Խ�������ɳ���Խ��
D. pH=12ʱ�������ϵ�з�������Ҫ��Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-
���𰸡�D
��������A����ΪPb(NO3)2��һ��ǿ�������Σ���ˮ��Һ�д�������ˮ��ƽ�⣺2H2O+Pb2+![]() Pb��OH��2+2H+��ʹc��Pb2+����С������
Pb��OH��2+2H+��ʹc��Pb2+����С������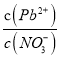 <
<![]() ��ѡ��A����B���Ȼ��ˮ��ʹ������Ũ����������Pb2+ˮ�⣬ƽ��2H2O+Pb2+
��ѡ��A����B���Ȼ��ˮ��ʹ������Ũ����������Pb2+ˮ�⣬ƽ��2H2O+Pb2+![]() Pb��OH��2+2H+�����ƶ���ʹ��Һ��
Pb��OH��2+2H+�����ƶ���ʹ��Һ��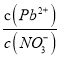 ��С��ѡ��B����C����ͼ��֪����3����pH��7��10ʱ��Pb(OH)2��������pH>10ʱ��Pb(OH)2�������٣�����Pb(NO3)2��Һ�еμ�NaOH��Һ��pH���������ɳ��������Ӻ���٣�ѡ��C����D��pH=12ʱ������4��Ũ�Ƚϴ��Pb(OH)3-Ũ�����½�������5�е�Pb(OH)42-Ũ��������������Pb(OH)3-ת��ΪPb(OH)42-����Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-��ѡ��D��ȷ����ѡD��
��С��ѡ��B����C����ͼ��֪����3����pH��7��10ʱ��Pb(OH)2��������pH>10ʱ��Pb(OH)2�������٣�����Pb(NO3)2��Һ�еμ�NaOH��Һ��pH���������ɳ��������Ӻ���٣�ѡ��C����D��pH=12ʱ������4��Ũ�Ƚϴ��Pb(OH)3-Ũ�����½�������5�е�Pb(OH)42-Ũ��������������Pb(OH)3-ת��ΪPb(OH)42-����Ӧ�����ӷ���ʽΪPb(OH)3-+OH-=Pb(OH)42-��ѡ��D��ȷ����ѡD��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�