题目内容
【题目】下列相应条件下不能发生电离的电解质是( )
A. 硫酸氢钠溶于水 B. 高温下氢氧化钠熔化
C. 固态醋酸熔化 D. 酒精溶于水
【答案】C
【解析】
A.硫酸氢钠是离子化合物,属于电解质,溶于水电离产生Na+、H+、SO42-,A不符合题意;
B.NaOH是离子化合物,属于电解质,在室温下呈固态,高温时氢氧化钠熔化电离产生自由移动的Na+、OH-,B不符合题意;
C.醋酸是由分子构成的电解质,当固态醋酸熔化时破坏的是分子间作用力,化学键没有断裂,没有自由移动的离子产生,所以未发生电离作用,C符合题意;
D.酒精是非电解质,溶于水也不发生电离作用,D不符合题意;
故合理选项是C。

【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
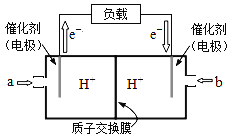
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.