题目内容
20.把9.2g Na和4.2g Si同时投入适量水中,在标况下产生氢气的体积是( )| A. | 2.8L | B. | 5.6L | C. | 11.2L | D. | 22.4L |
分析 发生反应:2Na+2H2O=2NaOH+H2↑、Si+2H2O+2NaOH=Na2SiO3+2H2↑,根据方程式计算Na反应生成氢气物质的量、氢氧化钠物质的量,再进行过量计算,根据不足量的物质计算Si与氢氧化钠溶液反应生成氢气的物质的量,根据V=nVm计算氢气体积.
解答 解:9.2g Na的物质的量为$\frac{9.2g}{23g/mol}$=0.4mol,4.2g Si的物质的量为$\frac{4.2g}{28g/mol}$=0.15mol,
2 Na+2H2O=2NaOH+H2↑
2 2 1
0.4mol 0.4mol 0.2mol
Si+2H2O+2NaOH=Na2SiO3+2H2↑
0.2mol 0.4mol
故Si完全反应,则生成氢气为0.15mol×2=0.3mol,
故标况下生成氢气为(0.2mol+0.3mol)×22.4L/mol=11.2L
故选C.
点评 本题考查化学方程式有关计算,侧重考查学生分析计算能力,明确发生的反应是解本题关键,难度不大,要注意进行过量计算.

练习册系列答案
相关题目
10.下列实验设计科学合理的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+ |
5.要除去下表中各粉末状混合物中的杂质,括号内为杂质,填写所用试剂和操作操作,如不需要则用/表示.
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
1.下列化学反应的方程式书写正确的是( )
| A. | 高温下加热硝酸铵固体:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HNO3↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 工业制粗硅:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si |
2.新华网达卡2010年8月6日电,为了解决生活用水问题,孟加拉政府在国际援助机构帮助下在全国各地打了数百万口深层管井,后来使用这些深层管井的居民逐渐开始出现砷中毒症状.经专家调查发现,孟加拉国土壤深层自然形成的砷含量非常高,目前数千万民众受到砷污染威胁.下列有关说法正确的是( )
| A. | 砷(As)位于周期表第4周期第ⅤA族 | B. | 气态氢化物稳定性:AsH3>PH3>NH3 | ||
| C. | 含氧酸酸性:H3AsO4>HNO3>H3PO4 | D. | 氢化物沸点:AsH3>PH3>NH3 |
 C70分子是形如椭球状的多面体,该结构的建立基于以下考虑
C70分子是形如椭球状的多面体,该结构的建立基于以下考虑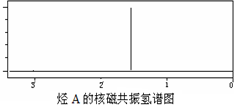
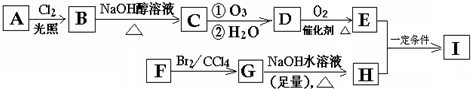
 ,C
,C .
. .
.
 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.