题目内容
4. 某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.
某研究学习小组用如图装置进行铜与浓硫酸反应的实验研究.(1)写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)从环境保护角度考虑,该方案存在不足之处是:碱液不足时二氧化硫有剩余,SO2造成环境污染
(3)实验中,0.1molCu与含0.2mol硫酸的溶液反应后,铜和硫酸都有剩余.可以证明有余酸的实验方案是AD
A.可再加入锌粒
B.可再加入氯化钡溶液
C.再加入银粉
D.再滴入碳酸氢钠溶液
(4)如果改用相同质量的锌分别和过量浓硫酸、稀硫酸反应,下列叙述正确的是D
A.两反应都有氢气生成
B.反应中转移的电子总数:前者多,后者少
C.反应生成气体的体积:前者多,后者少(同条件下)
D.消耗硫酸的物质的量:前者多,后者少.
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)由题意可知,铜与浓硫酸发生氧化还原反应,浓硫酸的还原产物是SO2,是大气污染性气体,应该用碱液吸收,从环境保护角度考虑,该方案用蘸用碱液的棉花吸收,如果碱液不足,SO2造成环境污染;
(3)由题意可知,只要证明该体系中有H+存在即可,可用活泼金属或碳酸氢钠,观察是否有气体生成;
(4)涉及方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑,结合反应的化学方程式以及元素化合价的变化判断.
解答 解:(1)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;
(2)由题意可知,铜与浓硫酸发生氧化还原反应,浓硫酸的还原产物是SO2,是大气污染性气体,应该用碱液吸收,从环境保护角度考虑,该方案用蘸有碱液的棉花吸收,如果碱液不足,SO2造成环境污染,故答案为:碱液不足时二氧化硫有剩余,SO2造成环境污染;
(3)A.Cu+2H2SO4 (浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,溶液中若有H2SO4剩余,加入锌粒,Zn+2H+=Zn2++H2↑,有气泡产生,故A正确;
B.若加入氯化钡溶液产生白色沉淀,不能说明有H2SO4剩余,因为该反应生成的CuSO4也会提供SO42-,故B错误;
C.不管H2SO4剩余与否,加入银粉没有现象,故C错误;
D.若加入碳酸氢钠溶液,若有H2SO4剩余,H++HCO3-=CO2↑+H2O,有气泡产生,故D正确,
故答案为:AD.
(4)有方程式可知:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,Zn+H2SO4=ZnSO4+H2↑
A.锌与过量的浓硫酸不会产生氢气,故A错误;
B.两个反应酸均过量,等量的锌完全反应,两个反应转移的电子数一样多,故B错误;
C.锌与浓硫酸反应,1molZn~1molSO2,锌与稀硫酸反应,1molZn~1molH2,两个反应锌是等量的,这两个反应产生的气体体积相等,故C错误;
D..锌与浓硫酸反应,1molZn~2mol浓H2SO4,锌与稀硫酸反应,1molZn~1molH2SO4,消耗硫酸的物质的量:前者多,后者少,故D正确.
故答案为:D.
点评 该题目考查金属与浓硫酸、稀硫酸反应的原理,难度不大.特别注意第(3)证明有余酸的实验方案,只要证明该体系中有H+存在即可,而不是证明SO42-的存在.

| A. | C2H4、C4H8 | B. | C2H2、C3H8 | C. | C3H4、C4H8 | D. | C3H4、C3H8 |
| A. | 过量二氧化碳通入偏铝酸钠溶液中:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| B. | 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合:NH4++HSO3-+2OH-═SO32-+NH3↑+2H2O | |
| C. | 氯气通入冷的烧碱溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O | |
| D. | 碳酸氢镁溶液中加入过量的石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
| A. | 2.8L | B. | 5.6L | C. | 11.2L | D. | 22.4L |
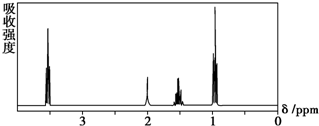
| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. | CH3CH2CH2OH | D. | CH3CH2COOH |
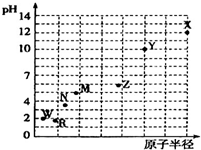 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
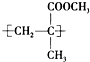 .
. ;
;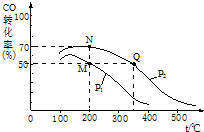 减少污染、保护环境是全世界最热门的课题.
减少污染、保护环境是全世界最热门的课题.