��Ŀ����
8��ij��A�����ϣԪ�ط���ʵ����̼����������Ϊ85.71%������������ͼ��ʾ���������ӷ������ʺɱ�Ϊ84�������ĺ˴Ź���������ͼ��ʾ����֪ϩ�����������÷�����Ӧ��CH3CH=CHCH3$��_{��H_{2}O}^{��O_{3}}$ 2CH3CHO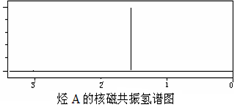
A������ת����ϵ���Ժϳɸ߷��ӻ�����I������B������ֻ����һ����ԭ�ӣ�F��A���ʽ��ͬ����F������״�������һ�֣�
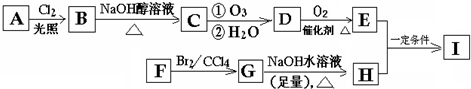
��ش��������⣺
��1��д���������ʵĽṹ��ʽ��A
 ��C
��C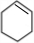 ��
����2��д�����з�Ӧ���ͣ�A��Bȡ����Ӧ��D��E������Ӧ��F��G�ӳɷ�Ӧ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��G��H��NaOH������CH2BrCH2Br+2NaOH $��_{��}^{ˮ}$CH2OHCH2OH+2NaBr��E+H��I
 ��
����4��A����״ͬ���칹���У�����˳���칹��A��ͬ���칹����4�֣�
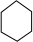
���� ��A��̼����������Ϊ85.71%������Ԫ�ص���������Ϊ1-85.71%=14.29%����N��C����N��H��=$\frac{85.71%}{12}$��$\frac{14.29%}{1}$=1��2���ʸ��������ʽΪCH2���������ӷ���ʺɱ�Ϊ84����������Է�������Ϊ84�������Ϊ��CH2��n����14n=84�����n=6���ʸ÷���ʽΪC6H12���ɸ����ĺ˴Ź�������֪���˴Ź�������ֻ��1���壬������ֻ��1��Hԭ�ӣ���AΪ ������������ȡ����Ӧ����B��B������ֻ����һ����ԭ�ӣ���BΪ
������������ȡ����Ӧ����B��B������ֻ����һ����ԭ�ӣ���BΪ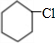 ��B������ȥ��Ӧ����CΪ
��B������ȥ��Ӧ����CΪ ��C������Ϣ�г�����������DΪOHC��CH2��4CHO��D����������Ӧ����EΪHOOC��CH2��4COOH��F��A���ʽ��ͬ����F������״�������һ�֣���FΪCH2=CH2�����巢���ӳɷ�Ӧ����GΪBrCH2CH2Br��G����ˮ�ⷴӦ����HΪHOCH2CH2OH��E��H�������۷�Ӧ���ɸ߾���HΪ
��C������Ϣ�г�����������DΪOHC��CH2��4CHO��D����������Ӧ����EΪHOOC��CH2��4COOH��F��A���ʽ��ͬ����F������״�������һ�֣���FΪCH2=CH2�����巢���ӳɷ�Ӧ����GΪBrCH2CH2Br��G����ˮ�ⷴӦ����HΪHOCH2CH2OH��E��H�������۷�Ӧ���ɸ߾���HΪ ���ݴ˽��
���ݴ˽��
��� �⣺��A��̼����������Ϊ85.71%������Ԫ�ص���������Ϊ1-85.71%=14.29%����N��C����N��H��=$\frac{85.71%}{12}$��$\frac{14.29%}{1}$=1��2���ʸ��������ʽΪCH2���������ӷ���ʺɱ�Ϊ84����������Է�������Ϊ84�������Ϊ��CH2��n����14n=84�����n=6���ʸ÷���ʽΪC6H12���ɸ����ĺ˴Ź�������֪���˴Ź�������ֻ��1���壬������ֻ��1��Hԭ�ӣ���AΪ ������������ȡ����Ӧ����B��B������ֻ����һ����ԭ�ӣ���BΪ
������������ȡ����Ӧ����B��B������ֻ����һ����ԭ�ӣ���BΪ ��B������ȥ��Ӧ����CΪ
��B������ȥ��Ӧ����CΪ ��C������Ϣ�г�����������DΪOHC��CH2��4CHO��D����������Ӧ����EΪHOOC��CH2��4COOH��F��A���ʽ��ͬ����F������״�������һ�֣���FΪCH2=CH2�����巢���ӳɷ�Ӧ����GΪBrCH2CH2Br��G����ˮ�ⷴӦ����HΪHOCH2CH2OH��E��H�������۷�Ӧ���ɸ߾���HΪ
��C������Ϣ�г�����������DΪOHC��CH2��4CHO��D����������Ӧ����EΪHOOC��CH2��4COOH��F��A���ʽ��ͬ����F������״�������һ�֣���FΪCH2=CH2�����巢���ӳɷ�Ӧ����GΪBrCH2CH2Br��G����ˮ�ⷴӦ����HΪHOCH2CH2OH��E��H�������۷�Ӧ���ɸ߾���HΪ ��
��
��1��������������֪��AΪ ��CΪ
��CΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
��2��������������֪��A��B����ȡ����Ӧ��D��E����������Ӧ��F��G���ڼӳɷ�Ӧ���ʴ�Ϊ��ȡ����Ӧ��������Ӧ���ӳɷ�Ӧ��
��3��G��H��NaOH��������Ӧ����ʽΪ��CH2BrCH2Br+2NaOH $��_{��}^{ˮ}$CH2OHCH2OH+2NaBr��
E+H��I�ķ�Ӧ����ʽΪ�� ��
��
�ʴ�Ϊ��CH2BrCH2Br+2NaOH $��_{��}^{ˮ}$CH2OHCH2OH+2NaBr�� ��
��
��4��A�� ������״ͬ���칹���У�����˳���칹��A��ͬ���칹�壬Ӧ����̼̼˫������ͬһ������̼ԭ�����Ӳ�ͬ��ԭ�ӻ���ţ��У�CH3CH2CH=CHCH2CH3��CH3CH=CHCH2CH2CH3��CH3CH=CHCH��CH3��2��CH3CH=C��CH3��C2H5���ʴ�Ϊ��4��
������״ͬ���칹���У�����˳���칹��A��ͬ���칹�壬Ӧ����̼̼˫������ͬһ������̼ԭ�����Ӳ�ͬ��ԭ�ӻ���ţ��У�CH3CH2CH=CHCH2CH3��CH3CH=CHCH2CH2CH3��CH3CH=CHCH��CH3��2��CH3CH=C��CH3��C2H5���ʴ�Ϊ��4��
���� ���⿼���л����ƶϡ��л���Ӧ���͡�ͬ���칹����д�ȣ�������A�и�Ԫ�ص�������������ͼ֪ʶ����ȷ��A�Ľṹ�ǹؼ����ٽ��ת����ϵ�ƶϣ��Ѷ��еȣ�

| A�� | Cl-Cl����H-H���ļ���С������ΪClԭ�ӱ�Hԭ�ӵķǽ�����ǿ | |
| B�� | H2��g����Cl2��g����Ӧ����2 molHCl��g������Ӧ�ġ�H=183 kJ/mol | |
| C�� | H2��g����Cl2��g����Ӧ����2 molHCl��g������Ӧ�ġ�H=-183 kJ/mol | |
| D�� | H2��g����Cl2��g����Ӧ����1 molHCl��g������Ӧ�ġ�H=-183 kJ/mol |
| A�� | �������Һ�м��������ϡ���ᣬ��Һ�������������Բ��� | |
| B�� | �������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ72g | |
| C�� | �������Һ�м��������ϡ�����KSCN��Һ����Һ��Ѫ��ɫ | |
| D�� | ����Һ��һ������Al3+��Ba2+��Cl- |
| A�� | Na+��Al3+��Cl-��OH-��5��2��7��4�� | B�� | NH4+��Ba2+��OH-��Cl-��1��1��1��2�� | ||
| C�� | Fe3+��Na+��Cl-��S2-��1��2��3��1�� | D�� | K+��H+��I-��HCO3-��1��1��1��1�� |
| A�� | ����������̼ͨ��ƫ��������Һ�У�AlO2-+CO2+2H2O�TAl��OH��3��+HCO3- | |
| B�� | ����Һ�����������������ʵ����������ƻ�ϣ�NH4++HSO3-+2OH-�TSO32-+NH3��+2H2O | |
| C�� | ����ͨ������ռ���Һ�У�2Cl2+2OH-�T3Cl-+ClO-+H2O | |
| D�� | ̼����þ��Һ�м��������ʯ��ˮ��Mg2++2HCO3-+Ca2++2OH-�TCaCO3��+2H2O+MgCO3�� |
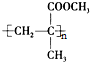 ������������������ȷ���ǣ�������
������������������ȷ���ǣ�������| A�� | ���л������Ļ�ѧ����Ϊ�ۼ���ϩ����� | |
| B�� | ���л���������2-��-��ϩ��ͼ״�Ϊԭ�ϣ�ͨ��������Ӧ���Ӿ۷�Ӧ�Ƶ� | |
| C�� | �����ʵ������л�������2-��-��ϩ�������������ͬ | |
| D�� | ����һ�������·���ˮ�ⷴӦʱ���ɵõ�����һ�ָ߷��ӻ����� |
| A�� | 2.8L | B�� | 5.6L | C�� | 11.2L | D�� | 22.4L |
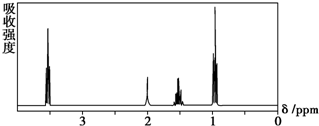
| A�� | CH3CH2CH2CH3 | B�� | ��CH3��2CHCH3 | C�� | CH3CH2CH2OH | D�� | CH3CH2COOH |
| A�� | ���ʯ�����ܻ�Ϊͬ���칹�� | B�� | N5��N2��Ϊͬ�������� | ||
| C�� | 14C��������Ϊ14 | D�� | Cԭ�Ӱ뾶��Nԭ�Ӱ뾶С |