题目内容
1.下列化学反应的方程式书写正确的是( )| A. | 高温下加热硝酸铵固体:NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HNO3↑ | |
| B. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 工业制粗硅:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si |
分析 A.硝酸铵分解发生氧化还原反应,生成硝酸、氮气和水;
B.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
C.硝酸能够氧化亚硫酸根离子生成硫酸根;
D.二者反应生成一氧化碳和硅.
解答 解:A.高温下加热硝酸铵固体,化学方程式:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2+9H2O,故A错误;
B.铝片加入烧碱溶液中,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故B正确;
C.亚硫酸钠被硝酸氧化生成硫酸钠,离子反应方程式为:3SO32-+2H++2NO3-=3SO42-+2NO↑+H2O,故C错误;
D.工业制粗硅,化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,故D错误;
故选:B.
点评 本题考查了化学方程式、离子方程式的书写,明确反应的实质是解题关键,注意反应必须符合客观事实,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、CO32-、HCO3-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
| A. | 若向该溶液中加入过量的稀硫酸,溶液中阴离子种类仍不变 | |
| B. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g | |
| C. | 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 该溶液中一定不含Al3+、Ba2+、Cl- |
20.把9.2g Na和4.2g Si同时投入适量水中,在标况下产生氢气的体积是( )
| A. | 2.8L | B. | 5.6L | C. | 11.2L | D. | 22.4L |
9.如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )
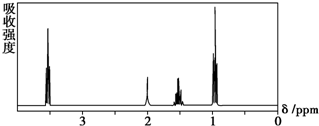

| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. | CH3CH2CH2OH | D. | CH3CH2COOH |
16.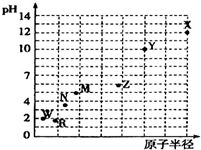 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
 第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )
第三周期元素的最高价氧化物对应水化物(浓度均为0.01mol•L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是( )| A. | 气态氢化物的稳定性:R>W | |
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 | |
| C. | Y的单质是制造汽车、飞机、火箭的重要材料 | |
| D. | 简单离子的半径X的最大 |
6.“环境问题”是当今全球共同关注的焦点,在哥本哈根气候大会上中国发挥了重要的作用.下列对环境造成危害的一组首要污染物是( )
| A. | CO2、SO2、O2 | B. | SO2、NO2、可吸入颗粒物 | ||
| C. | CO2、N2、O2 | D. | NO2、N2、可吸入颗粒物 |
10.据报道,碳纳米管是碳原子形成的大分子,其导电性是铜的1万倍;N5可以做烈性炸药.下列叙述正确的是( )
| A. | 金刚石和纳米管互为同分异构体 | B. | N5和N2互为同素异形体 | ||
| C. | 14C的质子数为14 | D. | C原子半径比N原子半径小 |
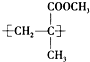 .
.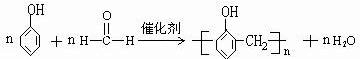 ;
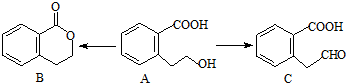
;
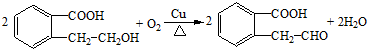 .
.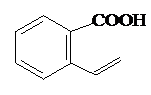 或
或 .
.