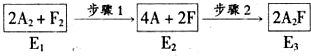题目内容
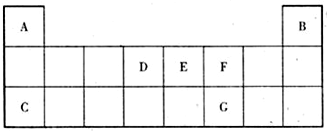
16.根据原子结构及元素周期律的知识,下列推断正确的是( )| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 某粒子${\;}_{z}^{A}$Rn+的核外电子数为Z+n | |
| C. | 41Ca与40Ca的失电子能力相同 | |
| D. | Cl?、S2?、Ca2+、K+半径逐渐减小 |
分析 A.处于金属与非金属交界处的元素具有一定的金属性与非金属性;
B.阳离子核外电子数=质子数-电荷数;
C.同位素原子化学性质几乎完全相同;
D.电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:A.处于金属与非金属交界处的元素具有一定的金属性与非金属性,如Al等,故A错误;
B.粒子${\;}_{z}^{A}$Rn+的核外电子数为Z-n,故B错误;
C.41Ca与40Ca互为同位素,失电子能力相同,故C正确;
D.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:S2?>Cl?>K+>Ca2+,故D错误,
故选C.
点评 本题考查元素周期表应用、原子构成、同位素、微粒半径比较,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
7.对H3O+的说法正确的是( )
| A. | O原子采取sp2杂化 | B. | O原子采取sp杂化 | ||
| C. | 离子中存在配位键 | D. | 离子中存在非极性键 |
11.常温常压下,下列各组物质的物理性质排列不正确的是( )
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
1.基态原子的核外电子排布的原则不包括( )
| A. | 能量最低原则 | B. | 能量守恒原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
5.下列每组中各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
6.“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3 | |
| B. | 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O | |
| C. | 制硫酸铜:Cu+2H2SO4=CuSO4+SO2↑+2H2O | |
| D. | 制硫酸铜:2Cu+O2=2CuO CuO+H2SO4(稀)=CuSO4+H2O |
 按要求完成下列各题:
按要求完成下列各题: .H2O的电子式为
.H2O的电子式为 .
.