题目内容
7.对H3O+的说法正确的是( )| A. | O原子采取sp2杂化 | B. | O原子采取sp杂化 | ||
| C. | 离子中存在配位键 | D. | 离子中存在非极性键 |
分析 根据价层电子对互斥理论确定其空间构型,价层电子对数=σ 键个数+$\frac{1}{2}$(a-xb);H3O+离子中不存在非极性键,存在的都是H-O极性共价键和配位键.
解答 解:A.H3O+中,O原子的价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,则O原子采取sp3杂化,故A错误;
B.H3O+中,O原子的价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,则O原子采取sp3杂化,故B错误;
C.在H3O+中O原子成3个共价键键,其中含有1个配位键,故C正确;
D.H3O+离子中不存在非极性键,存在的都是H-O极性共价键,故D错误.
故选:C.
点评 本题考查了杂化类型的判断、配位键和共价键,题目难度中等,注意理解价层电子对互斥理论与杂化轨道理论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列元素中,最高正化合价最大的是( )
| A. | C | B. | F | C. | S | D. | Ne |
2.在如图所示的装置中,a的金属活动性排在氢之前,b为碳棒,关于此装置的各种叙述正确的是( )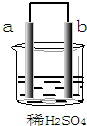

| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
12.用NA表示阿伏加德罗常数,下列叙述不正确的是( )
| A. | CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA | |
| B. | 78g过氧化钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为NA | |
| C. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| D. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA |
19.下列排列顺序不正确的是( )
| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 某粒子${\;}_{z}^{A}$Rn+的核外电子数为Z+n | |
| C. | 41Ca与40Ca的失电子能力相同 | |
| D. | Cl?、S2?、Ca2+、K+半径逐渐减小 |
17.下列说法正确的是( )
| A. | F是最活泼非金属,Li是最活泼金属 | |
| B. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | NaOH易溶于水,Ca(OH)2微溶,所以NaOH碱性比Ca(OH)2强 |
 .
. (1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下:
(1)反应A+3B?2C+2D在四种不同情况下的反应速率分别如下: