题目内容
(16分)过氧化钙(CaO2)常用作种子消毒剂、药物制造、 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 生成。有人提出:CO2、SO2与过氧化
生成。有人提出:CO2、SO2与过氧化 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
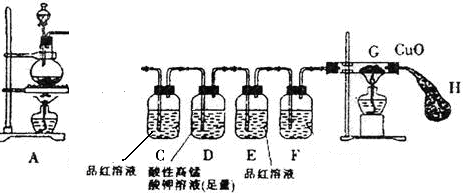
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:
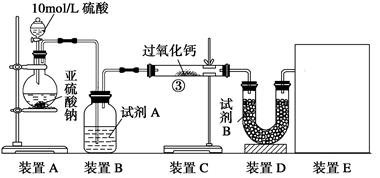
(1)试剂A可以选用 ,试剂B为碱石灰其作用是______________________。
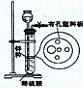
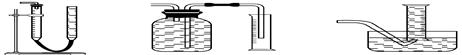
(2)装置E用于测定氧气 的体积
的体积 ,请在框中画出装置图。
,请在框中画出装置图。
(3)实验测得装 置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
若SO2完全氧化,写出反应的化学方程式:___________________________________。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
假设2:反应后固体中只有Na2SO4,SO2完全氧化;
假设3 :________________________________________________________________。
:________________________________________________________________。
实验探究:
(4)设计实验证明假设3是正确的,简要回答实验过程、现象和结论:________________
____________________________________________________________________________。
实 验评价:
验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:
____________________________________________________________________________。
 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 生成。有人提出:CO2、SO2与过氧化
生成。有人提出:CO2、SO2与过氧化 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:

(1)试剂A可以选用 ,试剂B为碱石灰其作用是______________________。
(2)装置E用于测定氧气
 的体积
的体积 ,请在框中画出装置图。
,请在框中画出装置图。(3)实验测得装
 置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。若SO2完全氧化,写出反应的化学方程式:___________________________________。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
假设2:反应后固体中只有Na2SO4,SO2完全氧化;
假设3
 :________________________________________________________________。
:________________________________________________________________。实验探究:
(4)设计实验证明假设3是正确的,简要回答实验过程、现象和结论:________________
____________________________________________________________________________。
实
 验评价:
验评价:(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:
____________________________________________________________________________。
(16分)(1)浓硫酸 吸收未反应的SO2
(2)
(其它合理答案均可)
(3) V=7m1/30 CaO2+SO2===CaSO4
反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生。再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化。
(5)若Na2O2剩余,固体加水溶解,过氧化钠能将SO氧化成SO。
(2)

(其它合理答案均可)
(3) V=7m1/30 CaO2+SO2===CaSO4
反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生。再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化。
(5)若Na2O2剩余,固体加水溶解,过氧化钠能将SO氧化成SO。
(1)试剂A可用浓硫酸,用于SO2的干燥,试剂B为碱石灰其作用是吸收未反应的SO2;
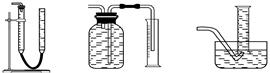
(2)测CaO2与SO2反应生成的氧气的体积,可用如右装置:
(3)当SO2未氧化时,发生的反应为
2CaO2+2SO2=2CaSO3+O2 ?m
2x72 2x120 22.4L 96
VL m1 22.4/V="96/" m1 V=7m1/30
SO2完全氧化,化学方程式为CaO2+SO2===CaSO4
假设3:反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)探究假设3是否正确,主要检验混合物中是否含Na2SO3及Na2SO4,即设计实验证明Na2SO3、Na2SO4的存在,可取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,则Na2O2将SO2部分氧化。(5)由于过氧化钠能将SO氧化成SO,则不能确定过氧化钠与SO2是否生成了Na2SO3、Na2SO4的混合物,所以通入的SO2应足量,使过氧化钠无剩余。
(2)测CaO2与SO2反应生成的氧气的体积,可用如右装置:

(3)当SO2未氧化时,发生的反应为
2CaO2+2SO2=2CaSO3+O2 ?m
2x72 2x120 22.4L 96
VL m1 22.4/V="96/" m1 V=7m1/30
SO2完全氧化,化学方程式为CaO2+SO2===CaSO4
假设3:反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)探究假设3是否正确,主要检验混合物中是否含Na2SO3及Na2SO4,即设计实验证明Na2SO3、Na2SO4的存在,可取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,则Na2O2将SO2部分氧化。(5)由于过氧化钠能将SO氧化成SO,则不能确定过氧化钠与SO2是否生成了Na2SO3、Na2SO4的混合物,所以通入的SO2应足量,使过氧化钠无剩余。

练习册系列答案
相关题目

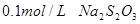 溶液、
溶液、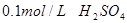 、烧杯、冷水、热水、秒表等
、烧杯、冷水、热水、秒表等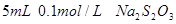 。
。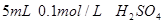 。
。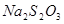 和
和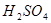 反应的化学方程式为 。
反应的化学方程式为 。