题目内容
(13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
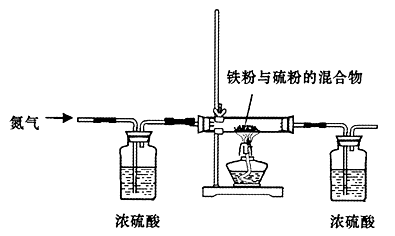
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。

步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。
(1)NH4+ + NO2-  N2↑+2H2O (2分)
N2↑+2H2O (2分)
(2)赶走装置中的空气 (2分)
(3)有白色浑浊出现 (2分)
(4)取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe2+,则黑色固体中铁的化合价为+2价。(3分)
(5)防止未反应的铁与稀硫酸反应生成Fe2+干扰实验 (2分)
(6)除去未反应的硫 (2分)
 N2↑+2H2O (2分)
N2↑+2H2O (2分)(2)赶走装置中的空气 (2分)
(3)有白色浑浊出现 (2分)
(4)取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe2+,则黑色固体中铁的化合价为+2价。(3分)
(5)防止未反应的铁与稀硫酸反应生成Fe2+干扰实验 (2分)
(6)除去未反应的硫 (2分)
(1)氮元素发生了归中反应:NH4+ + NO2-  N2↑+2H2O
N2↑+2H2O
(2)防止铁粉或硫粉被氧气氧化
(3)固体溶液产生的铁离子与硫化氢生成硫单质:2Fe3++H2S=2Fe2++S↓+2H+,有淡黄色或乳白色浑浊出现
(4)也就是亚铁离子的检验(FeS+2H+=Fe2++H2S↑):
取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe2+,则黑色固体中铁的化合价为+2价
(5)在步骤三中固体中加酸,需要通过对Fe2+的检验来判定FeS,而铁可以与酸产生Fe2+,所以必须使硫粉过量
(6)过量的硫可溶于碱液:3S+6OH-=S2-+SO32-+3H2O
 N2↑+2H2O
N2↑+2H2O(2)防止铁粉或硫粉被氧气氧化
(3)固体溶液产生的铁离子与硫化氢生成硫单质:2Fe3++H2S=2Fe2++S↓+2H+,有淡黄色或乳白色浑浊出现
(4)也就是亚铁离子的检验(FeS+2H+=Fe2++H2S↑):
取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe2+,则黑色固体中铁的化合价为+2价
(5)在步骤三中固体中加酸,需要通过对Fe2+的检验来判定FeS,而铁可以与酸产生Fe2+,所以必须使硫粉过量
(6)过量的硫可溶于碱液:3S+6OH-=S2-+SO32-+3H2O

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目



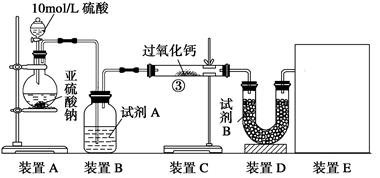
 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
 的体积
的体积
 -二氯乙烷已发生消去反应的现象是_______________,还可通过什
-二氯乙烷已发生消去反应的现象是_______________,还可通过什 么实验加以验证:________________________________________。
么实验加以验证:________________________________________。