题目内容
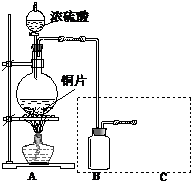
.(16分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是________________________________________________________;
E装置的作用__________________________________________________________。
(4)通入C装置的两根导管左边较长、右边较短,目的是_________________________。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。
当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)_________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。
请回答下列问题:
(1)装置F中发生反应的离子方程式为________________________________________。
(2)装置A的烧瓶中可装试剂_______________________________________________。
(3)B装置的名称是________________________________________________________;
E装置的作用__________________________________________________________。
(4)通入C装置的两根导管左边较长、右边较短,目的是_________________________。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________________________________________________。
当有a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为(用含a、b的代数式表示)_________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。
(每空2分共16分)
(1)MnO2+4H++2Cl-=====△Mn2++Cl2↑+2H2O
(2)生石灰或固体氢氧化钠
(3)干燥管 除去氯气中的氯化氢
(4)使密度大的氯气与密度小的氨气较快地均匀混合
(5)3Cl2+8NH3===N2+6NH4Cl b/2a mol-1
(6)在G连接导管直接通入盛有烧碱的烧杯中
(1)MnO2+4H++2Cl-=====△Mn2++Cl2↑+2H2O
(2)生石灰或固体氢氧化钠
(3)干燥管 除去氯气中的氯化氢
(4)使密度大的氯气与密度小的氨气较快地均匀混合
(5)3Cl2+8NH3===N2+6NH4Cl b/2a mol-1
(6)在G连接导管直接通入盛有烧碱的烧杯中
:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1- 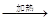 Mn2++C12↑+2H2O.
Mn2++C12↑+2H2O.
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、C.生石灰、E.烧碱都是碱性物质,且溶解于水时放出热量,D.五氧化二磷
、B.浓硫酸虽然溶于水时放热,但是酸性物质.
故选A、C、D.
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故选Ⅱ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅰ;水蒸气常用浓硫酸除去,故D选Ⅲ.
故答案为:Ⅱ、Ⅲ、Ⅰ.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2;
氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
故答案为:8NH3+3C12=6NH4C1+N2;将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
(5)氯气有毒,所以不能直接排空,但氯气能和水反应生成盐酸和次氯酸,盐酸和次氯酸都能和氢氧化钠反应生成盐,所以除去氯气应选用氢氧化钠溶液吸收,方法为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.
故答案为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.
 Mn2++C12↑+2H2O.
Mn2++C12↑+2H2O.(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、C.生石灰、E.烧碱都是碱性物质,且溶解于水时放出热量,D.五氧化二磷
、B.浓硫酸虽然溶于水时放热,但是酸性物质.
故选A、C、D.
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故选Ⅱ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅰ;水蒸气常用浓硫酸除去,故D选Ⅲ.
故答案为:Ⅱ、Ⅲ、Ⅰ.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2;
氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
故答案为:8NH3+3C12=6NH4C1+N2;将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
(5)氯气有毒,所以不能直接排空,但氯气能和水反应生成盐酸和次氯酸,盐酸和次氯酸都能和氢氧化钠反应生成盐,所以除去氯气应选用氢氧化钠溶液吸收,方法为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.
故答案为:将导气管与G口连接,另一端插入盛有NaOH溶液的烧杯中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目







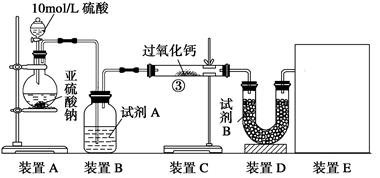
 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
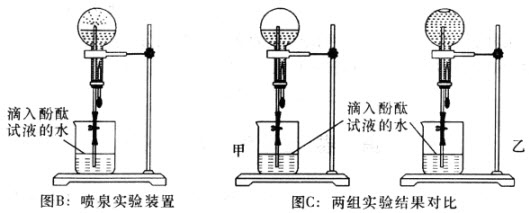
 的体积
的体积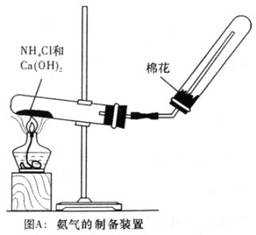
 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验: