题目内容
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为 。
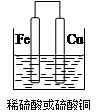
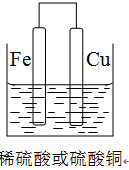
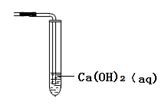
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。

上述装置中正极反应式为 。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用 。
(3)利用提供的试剂和用品:0.1 mol·L-1盐酸溶液、0.1 mol·L-1醋酸溶液、0.5 mol·L-1氯化铝溶液、0.5 mol·L-1氢氧化钠溶液、PH试纸。
请设计最简单实验证明氢氧化铝为弱碱
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
_____________ 、_____________ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为 。
(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性。试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液。

上述装置中正极反应式为 。
②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用 。
| A.0.5 mol·L-1氯化亚铁溶液 | B.0.5 mol·L-1氯化铜溶液 |
| C.0.5 mol·L-1盐酸 | D.0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液 |
请设计最简单实验证明氢氧化铝为弱碱
(1)盐酸的浓度(1分);溶液的温度(1分); 硫酸亚铁溶液(或其他的亚铁盐溶液)(2分);
(2)①(2分)
2H+ + 2e- = H2↑ 或Cu2+ + 2e-= Cu (2分)
②D (2分)
(3) 取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。(2分)
(2)①(2分)

2H+ + 2e- = H2↑ 或Cu2+ + 2e-= Cu (2分)
②D (2分)
(3) 取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。(2分)
试题分析:(1)要验证Al、Fe、Cu的金属活动性,除选择大小相同的金属片外,还需要控制盐酸的浓度和溶液的温度相同,还可以用硫酸亚铁溶液(或其他的亚铁盐溶液)来验证三种金属的活泼性;(2)①若用Fe、Cu作电极设计成原电池,则Fe为负极,Cu为正极,可以用稀硫酸或者是硫酸铜为电解质溶液,所以该装置图为
 ,若电解质为稀硫酸,则正极反应式为 2H+ + 2e- = H2↑,若电解质溶液为硫酸铜,则正极反应式为Cu2+ + 2e-=" Cu" ;②用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液;(3)可以测定铝的强酸盐的pH来判断,其实验过程为取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。
,若电解质为稀硫酸,则正极反应式为 2H+ + 2e- = H2↑,若电解质溶液为硫酸铜,则正极反应式为Cu2+ + 2e-=" Cu" ;②用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用0.5 mol·L-1氯化亚铁和0.5 mol·L-1氯化铜混合溶液;(3)可以测定铝的强酸盐的pH来判断,其实验过程为取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱。点评:本题利用原电池的知识来设计实验比较金属的活动性,这有利于培养学生的探究性思维,该题难度适中。

练习册系列答案
相关题目
 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。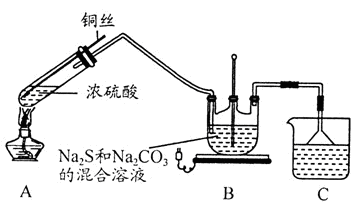
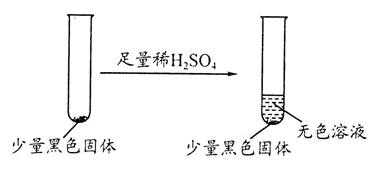


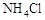 晶体时,将湿润的红色石蕊试纸靠近试管口,检验
晶体时,将湿润的红色石蕊试纸靠近试管口,检验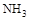 的生成
的生成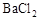 溶液,有白色沉淀生成,说明原溶液中存在
溶液,有白色沉淀生成,说明原溶液中存在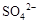
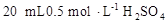 溶液于烧杯中,加水80mL,,配制成0.1
溶液于烧杯中,加水80mL,,配制成0.1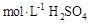 溶液
溶液
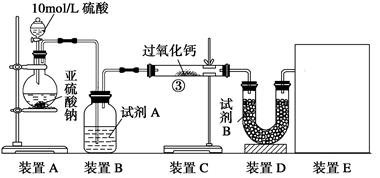
 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
 的体积
的体积