题目内容
【题目】室温下,取一定量冰醋酸,进行如下实验:
① 将冰醋酸配制成0.1 mol·L-1醋酸溶液;
② 取20 mL①所配溶液,加入a mL 0.1 mol·L-1 NaOH溶液,充分反应后,测得溶液pH=7;
③ 向②所得溶液中继续滴加稀盐酸,直至溶液中n(Na+) = n(Cl-)。
下列说法正确的是
A.①中:所得溶液的pH=1
B.②中:a=20
C.③中:所得溶液中c(CH3COO-)<c(H+),且pH<7
D.①与③所得溶液相比,等体积时所含CH3COOH分子数目相等
【答案】C
【解析】
A.因为醋酸是弱酸,故①中0.1mol/L的醋酸pH>1,A错误;
B.若②中a=20,则醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸钠水解显碱性,B错误;
C.③中溶液的电荷守恒为:![]() ,结合
,结合![]() ,故
,故![]() ,所以
,所以![]() ,
,![]() ,pH<7,C正确;
,pH<7,C正确;
D. ①与③所得溶液相比,③相当于向①中加入了氯化钠溶液,越稀越电离,故等体积时③中醋酸分子数少,D错误;
答案选C。

【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
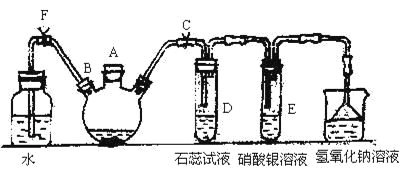
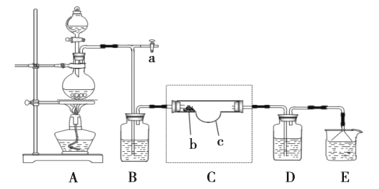
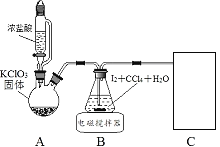
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
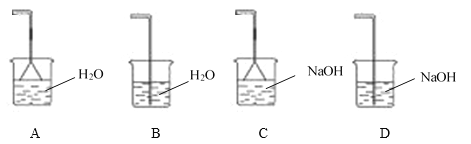
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。