题目内容
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物质的量的变化如图所示。下列说法正确的是
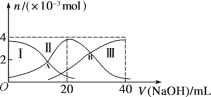
A. 当V(NaOH)=20 mL时,溶液中离子浓度关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 当V(NaOH)=30 mL时,则有:2c(H+) + c(HA-) +2c(H2A) =c(A2-) +2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH减小
D. 若A、B两点对应的溶液pH值分别为a、b,则H2A![]() 2H++A2-的K=10-a-b
2H++A2-的K=10-a-b
【答案】D
【解析】
A.根据图象知,当V(NaOH)=20mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
B. 当V(NaOH)=30 mL时,溶质Na2A和NaHA且为1:1,根据电荷守恒和物料守恒判断;
C. NaHA以电离为主,溶液显酸性,加水稀释,酸性减弱;
D.根据A、B两点对应的溶液pH值分别为a、b,分别计算出H2A电离平衡常数K1和K2,然后在根据H2A![]() 2H++A2-计算K值。
2H++A2-计算K值。
A. 当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O;溶液主要为NaHA, HA-电离大于水解,溶液显酸性,结合水的电离平衡可知,c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-), 故A错误;
B. 当V(NaOH)=30 mL时,溶液中溶质为Na2A和NaHA且为1:1;溶液中电荷守恒:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),物料守恒:2c(Na+)=3c(A2-)+3c(HA-)+3c(H2A),所以溶液中存在以下关系:2c(H+)+3c(H2A)+ c(HA-)=c(A2-) +2c(OH-),B错误;
C.二者恰好反应生成NaHA,加水稀释促进HA电离和水解,因为电离程度大于水解程度,溶液呈酸性,加水稀释导致氢离子个数增大,但氢离子物质的量的增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,溶液的pH增大,故C错误;
D. A点时,溶液中c(H2A )=c(HA-),H2A第一步电离的电离常数为K1= c(HA-)×c(H+)/ c(H2A )=10-a;B点时,溶液中c(A2- )=c(HA-),H2A第一步电离的电离常数为K2= c(A2- )×c(H+)/c(HA-)= 10-b ;H2A![]() 2H++A2-的K= c(A2- )×c2(H+)/c(H2A )= K2×K1=10-b×10-a=10-a-b,D正确;
2H++A2-的K= c(A2- )×c2(H+)/c(H2A )= K2×K1=10-b×10-a=10-a-b,D正确;
综上所述,本题选D。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2) B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________ (标出配位键),其中心原子的 VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
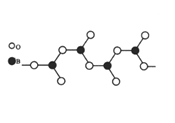
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1 | 图2 | 图3 |
|
|
|
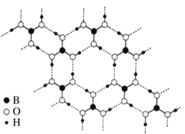
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________;同一片层划分出的一个二维晶胞(平行四边形)含有_______个H3BO3分子。
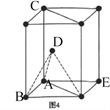
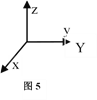
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg属六方最密堆积,其晶胞结构如图4所示,若在晶胞中建立如图5所示的坐标系,以A为坐标原点,把晶胞的底边边长和高都视作单位1,则B、E 、C的坐标分别为B(1,0,0)、E(0,1,0)C(0,0,1),请写出D点的坐标:D:__________________