题目内容
【题目】某氮的氧化物和灼热的铁按4NxOy+3yFe=yFe3O4+2xN2的反应式进行反应。在一个特定的实验中,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。该氧化物的化学式为( )
A.NOB.NO2C.N2OD.N2O4
【答案】B
【解析】
由题意可知,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。生成1mol四氧化三铁转移8mol电子,则生成1mol氮气就转移8mol电子,所以平均1个氮原子得到4个电子,所以氧化物NxOy中x=1,则氮元素的化合价是+4价,该氧化物为NO2,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】A部分:由锆英砂(ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)制备ZrO2的流程如下:

已知:①ZrO2在强碱性溶液中以ZrO32-形式存在,在强酸性溶液中以ZrO2+形式存在。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
Mn+ | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.8 | 5.6 | 8.0 |
(1)操作I所需要的玻璃仪器为___________,操作I除了得到溶液a还可得到_________。
(2)加氨水至溶液a中调节pH的的范围是________________。
(3)操作II会得到滤液b和滤渣II,滤渣II分离过程如下:
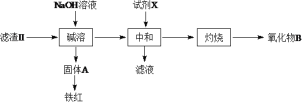
氧化物B的化学式为__________。若试剂X为盐酸,缺点是___________。
(4)操作III除得到Zr(OH)4外还得到某种溶液,向该溶液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为_____________________________。
(5)加入氨水至溶液b发生的离子方程式为__________________________。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
B部分:钛精矿是从钛铁矿或钛磁铁矿中采选出来,主要成分为FeTiO3,是生产用途非常广泛的钛白粉的原料。以钛精矿石为原料制备金属钛的流程如下图所示(某些过滤过程已忽略)。已知强酸性溶液中,+4价的钛元素以TiO2+形式存在,金属钛不溶于稀非氧化性酸。回答下列问题:

(1)步骤②中加入铁屑的作用是__________________。
(2)晶体K俗称绿矾,晶体K的化学式为____________。
(3)试写出溶液C加热制备钛酸沉淀的化学方程式__________________________________。
(4)步骤⑥加入过量的活性炭,则发生的化学方程式为_______________,已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
(5)气体F为氩气,F的作用是_____________________。
(6)溶液H是_________,作用为___________________________。