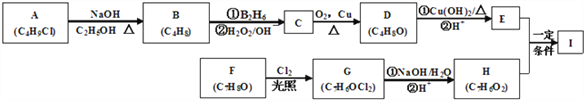
题目内容
【题目】SiO2是____________的酸酐,不溶于水。常温下和NaOH溶液反应的化学方程式为________;碱性试剂不能保存在______塞的试剂瓶中。高温下,SiO2和碱性氧化物(如CaO)反应的化学方程式为:_______;常温下SiO2和氢氟酸反应的化学方程式_______。
【答案】硅酸 SiO2+2NaOH=Na2SiO3+H2O 玻璃 SiO2+CaO![]() CaSiO3 SiO2+4HF=SiF4 ↑+2H2O
CaSiO3 SiO2+4HF=SiF4 ↑+2H2O
【解析】
酸酐是含氧酸脱去一分子水或几分子水后剩余的物质;常温下SiO2和NaOH溶液反应产生硅酸钠和水,硅酸盐有粘性,会将玻璃瓶与玻璃塞粘在一起,因此碱性试剂不能使用玻璃塞,要用橡胶塞或软木塞;SiO2是酸性氧化物,可以与碱性氧化物在高温下反应产生硅酸盐,可以与氢氟酸反应产生四氟化硅和水。
SiO2是H2SiO3脱去一分子水后剩余的物质,因此SiO2是硅酸的酸酐;在常温下SiO2和NaOH溶液反应生成硅酸钠和水,该反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,所以二氧化硅是酸性氧化物;玻璃的主要成分是二氧化硅,二氧化硅与碱性试剂反应产生的硅酸盐具有粘性,会将玻璃瓶与玻璃塞粘在一起,因此碱性试剂不能保存在玻璃塞 的试剂瓶中;SiO2中Si、O原子间以共价键结合,断裂消耗很高的能量,CaO是离子化合物,Ca2+、O2-间以离子键结合,断裂为离子也需要很高的能量,因此在高温下,当SiO2、CaO获得足够能量时,会发生反应生成硅酸钙,反应的化学方程式为:SiO2+CaO![]() CaSiO3;常温下SiO2可以和氢氟酸反应产生SiF4、H2O,反应的化学方程式为SiO2+4HF=SiF4 ↑+2H2O。
CaSiO3;常温下SiO2可以和氢氟酸反应产生SiF4、H2O,反应的化学方程式为SiO2+4HF=SiF4 ↑+2H2O。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】(8分).氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是 。
A.制汽轮机叶片 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,她不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式为 。
(3)现用四氯化硅和氮气在氢气中加强热发生反应,可制得高纯度氮化硅,反应的化学方程式为 。