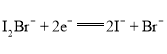题目内容
【题目】维生素C的分子式是C6H8O6,水溶液呈酸性,高温或较长时间受热易损耗,许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素C,例如:新鲜橙汁中含维生素C浓度在500mg·L-1左右。某校化学课外活动小组进行测定果汁中维生素C含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
Ⅰ实验目的:测定××牌软包装鲜橙汁维生素C含量。
Ⅱ实验原理:C6H8O6+I2→C6H6O6+2H++2I-。
Ⅲ实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
Ⅳ实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用标准液润洗的仪器是_____________。
(2)打开橙汁包,目测:颜色-橙黄色,澄清度-好,将仪器____________盛装该橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是____________。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视___________。滴定至终点时的现象是__________。
(4)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是___________mg·L-1。
【答案】酸式滴定管 碱式滴定管 淀粉溶液 锥形瓶 溶液由无色变为蓝色,且半分钟颜色不恢复 1320
【解析】
根据滴定管的构造及所盛试剂的性质分析用哪种滴定管;根据滴定原理及碘水的性质分析选择指示剂及滴定终点的现象;根据滴定反应原理由标准液的浓度及实验数据计算待测液的浓度。
(1)标准液为碘水,碘水对橡胶管具有腐蚀性,所以应用酸式滴定管存放,故需用标准液润洗的仪器是酸式滴定管;故答案为:酸式滴定管;
(2)标准液存放在酸式滴定管中,则待测的橙汁应该用碱式滴定管移取,淀粉遇碘变蓝,所以可以用淀粉溶液作为指示剂,故答案为:碱式滴定管;淀粉溶液;
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化。滴定至终点时的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色,故答案为: 锥形瓶;溶液由无色变为蓝色,且半分钟颜色不恢复;
(4)20mL标准碘溶液含有碘的质量为254g/mol×0.02L×7.5×103molL1=38.1mg,设20.0mL待测橙汁中维生素C的质量为x,
根据C6H8O6+I2→C6H6O6+2H++2I-计算得:x=![]() =26.4mg,则1L中含维生素C的质量为26.4mg×
=26.4mg,则1L中含维生素C的质量为26.4mg×![]() =1320mg,所以,则此橙汁中维生素C的含量是1320mg/L,故答案为:1320。
=1320mg,所以,则此橙汁中维生素C的含量是1320mg/L,故答案为:1320。

 阅读快车系列答案
阅读快车系列答案