题目内容
【题目】A~F均为中学化学常见的物质,它们之间存在如下转化关系,其中C和D的稀溶液不反应,B、C与D反应还可生成A(产物水等略去)。下列说法错误的是

A.铂丝蘸取A溶液灼烧,焰色反应显蓝绿色
B.D的浓溶液有强氧化性
C.E是一种有毒气体,不能用作食品添加剂
D.A的溶液电解时,阳极反应式为4OH--4e-=2H2O+O2↑
【答案】C
【解析】
单质C与D的浓溶液反应,与稀溶液不反应,可确定,C为Cu,D为硫酸,用惰性电极电解硫酸铜溶液,生成硫酸、铜和氧气,则单质B为氧气;铜与浓硫酸反应生成硫酸铜和二氧化硫,则E为二氧化硫,F为三氧化硫。
A.铂丝蘸取硫酸铜溶液灼烧,铜元素的焰色反应显蓝绿色,A说法正确;
B.硫酸的浓溶液有强氧化性,B说法正确;
C.SO2 具有优秀的杀菌能力,能消灭细菌,常用作红酒的食品添加剂,C说法错误;
D.惰性电极电解硫酸铜的溶液时,阳极水电离出的氢氧根离子失电子生成氧气,反应式为4OH--4e-=2H2O+O2↑,D说法正确;
答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ: 取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3![]() 2NaI+Na2S4O6)
2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________;
(2)步驟Ⅱ判断滴定达到终点的现象是___________________________;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________;
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72- 的物质的量为___________mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是_____________;(填字母代号)
a. Cr2O72- 和CrO42- 的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,溶液的pH应调至___________。
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________。
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
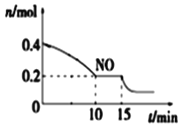
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.升温 B.增大CO浓度 C.加入催化剂 D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=_________________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分別在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O![]() CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
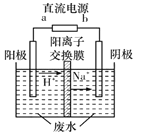
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分別为4OH--4e-=O2↑+2H2O、__________________。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分別注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______kg(计算结果保留2位小数)。