题目内容
 请认真观察图,然后回答问题.
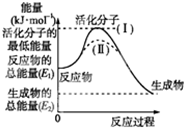
请认真观察图,然后回答问题.(1)图中反应是
(2)已知热化学方程式:H2(g)+
| 1 |
| 2 |
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)依据图象分析,反应物能量高于生成物能量,依据能量守恒分析反应是放热反应,反应物发生反应的活化能是反应物需要提供能量达到,反应焓变△H=生成物总能量-反应物总能量=E2-E1;
(2)逆反应的活化能=正反应活化能-反应焓变得到;
(3)图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,但反应热不变,化学平衡不变.
(2)逆反应的活化能=正反应活化能-反应焓变得到;
(3)图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,但反应热不变,化学平衡不变.
解答:
解:(1)图象分析,反应物能量高于生成物能量,依据能量守恒分析反应是放热反应,反应发生需要提供能量达到能量E1使反应物变化为活化分子发生有效碰撞发生反应,反应的焓变△H=生成物总能量-反应物总能量=E2-E1;
故答案为:放热;需要;E2-E1;
(2)已知热化学方程式:H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能=正反应活化能-反应焓变=167.2KJ/mol-(-241.8KJ/mol)=409.0KJ/mol,
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,反应焓变不变,平衡不变,依据影响平衡因素分析是使用了催化剂,改变反应速率不改变平衡和反应热,
故答案为:使用催化剂.
故答案为:放热;需要;E2-E1;
(2)已知热化学方程式:H2(g)+
| 1 |
| 2 |
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,反应焓变不变,平衡不变,依据影响平衡因素分析是使用了催化剂,改变反应速率不改变平衡和反应热,
故答案为:使用催化剂.
点评:本题考查了化学反应能量变化分析,图象理解应用,注意活化能概念的分析,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列实验能成功的是①用灼烧法鉴别Na2CO3固体和NaHCO3固体 ②用观察法区别Na2O粉末和Na2O2粉末 ③用AlCl3溶液鉴别Na2CO3溶液和NaOH溶液 ④用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液( )
| A、全部 | B、①②④ |
| C、②③④ | D、①②③ |
为了提高煤燃烧的热效率并减少对环境的污染,不能采取的措施是( )
| A、通入大量的空气 |
| B、将固体燃料粉碎,使之充分燃烧 |
| C、把煤转化为液态燃料 |
| D、将煤处理转化为气体燃料 |
如果25℃时KW=10-14,100℃时KW=10-12,这说明( )
| A、100℃时水的电离常数较大 |
| B、前者c(H+)比后者大 |
| C、水的电离过程是一个放热过程 |
| D、KW和K电离无直接关系 |
下列有关说法正确的是( )
| A、单质Na可通过电解NaCl溶液制得 |
| B、石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
对于常温下pH为2的盐酸,叙述正确的是( )
| A、溶液中c(H+)=c(Cl-) |
| B、与等体积pH=12的氨水混合后所得溶液显酸性 |
| C、由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍 |
| D、与等体积0.01 moI?L-1碳酸钠溶液混合后所得溶液中:c(Na+)═c(CO32-)+c(H2CO3) |
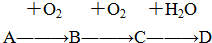 A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):
A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去):