题目内容
【题目】下列说法正确的是
A. C2H2分子中σ键与π键的数目比为1:1且σ键比π键重叠程度大,形成的共价键强
B. SO2和CS2均为V形的极性分子
C. ①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是①②⑤
D. SiF4和SO32-的中心原子均为sp3杂化
【答案】D
【解析】C2H2分子中σ键与π键数目比为3:2,A错误;CS2中价层电子对个数![]() ,且该分子中正负电荷重心重合,所以为直线形非极性分子,B错误;①
,且该分子中正负电荷重心重合,所以为直线形非极性分子,B错误;①![]() 中O提供孤电子对,
中O提供孤电子对,![]() 提供空轨道,二者形成配位键,
提供空轨道,二者形成配位键,![]() 含有配位键②
含有配位键②![]() 有空轨道,
有空轨道,![]() 中的氮原子上的孤电子对,可以形成配位键,
中的氮原子上的孤电子对,可以形成配位键,![]() 含有配位键③
含有配位键③![]() 中碳和氧最外层有8个电子达到稳定结构,氢满足2电子稳定结构,无空轨道,无孤电子对,电子式为
中碳和氧最外层有8个电子达到稳定结构,氢满足2电子稳定结构,无空轨道,无孤电子对,电子式为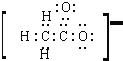 ,不含有配位键;④
,不含有配位键;④![]() 为共价化合物,氮原子中最外层有8个电子达到稳定结构,分子中存在两个
为共价化合物,氮原子中最外层有8个电子达到稳定结构,分子中存在两个![]() 键,氢满足2电子稳定结构,无空轨道;⑤CH4为共价化合物,C原子中最外层有8个电子达到稳定结构,分子中存在4个C-H键,氢满足2电子稳定结构,无空轨道;以上粒子存在配位键的是①②,C错误;SiF4中价层电子对个数
键,氢满足2电子稳定结构,无空轨道;⑤CH4为共价化合物,C原子中最外层有8个电子达到稳定结构,分子中存在4个C-H键,氢满足2电子稳定结构,无空轨道;以上粒子存在配位键的是①②,C错误;SiF4中价层电子对个数![]() ,SO32-中价层电子对个数
,SO32-中价层电子对个数![]() ,所以
,所以![]() 和
和![]() 中中心原子的价层电子对数均为4,因此中心原子均为
中中心原子的价层电子对数均为4,因此中心原子均为![]() 杂化,D正确的;正确选项D。
杂化,D正确的;正确选项D。

练习册系列答案
相关题目