题目内容
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+ O2→2CH3CHO。下列有关说法正确的是
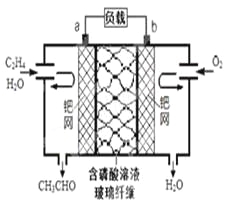
A. 该电池为可充电电池
B. 每有0.1mol O2反应,则迁移H+ 0.4mol
C. 正极反应式为:CH2=CH2-2e-+ 2OH-→CH3CHO + H2O
D. 电子移动方向:电极a→磷酸溶液→电极b
【答案】B
【解析】试题分析:A、充电时,不能生成乙烯和氧气,不是充电电池,故A错误;B、由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则迁移H+0.4mol,故B正确;C、正极发生还原反应,电极方程式为O2+4H++4e-═2H2O,负极为CH2=CH2-2e-+H2O=CH3CHO+2H+,故C错误;D、电子只能经过导线,不能经过溶液,故D错误,故选B。

练习册系列答案
相关题目
【题目】已知下列原子的半径:
原子 | N | S | O | Si |
半径r/10-10 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,P原子的半径可能是( )
A.1.10×10-10 mB.1.08×10-10 m
C.1.20×10-10 mD.0.70×10-10 m


