题目内容
10.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:Ba2++SO42-=BaSO4↓.分析 加入Ba(OH)2溶液至中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,以此书写离子方程式;
至中性时溶液中溶质只有Na2SO4,加入Ba(OH)2溶液生成BaSO4沉淀.
解答 解:NaHSO4是二元强酸的酸式盐,可以理解为全部电离.当反应后溶液呈中性时,其反应式为:2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,则离子反应方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,此时溶液中溶质只有Na2SO4,加入Ba(OH)2的离子反应方程式为:Ba2++SO42-=BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查离子方程式的书写,为高频考点,注意根据物质的量判断反应的程度并书写相关离子方程式,注意与量有关的离子方程式的书写方法,题目难度不大.

练习册系列答案
相关题目
20.下列说法不正确的是( )
| A. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为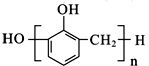 | |
| B. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| C. | 醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 | |
| D. | 迷迭香酸的结构为  它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
1.a-5X、b-3Y、aZ、bW、a+4T均为短周期元素,其原子半径随原子序数变化如图所示.Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍.则下列说法正确的是( )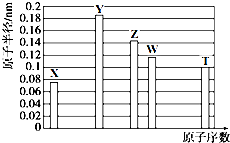

| A. | Z、T两种元素的离子半径相比,前者较大 | |
| B. | X、Y形成的两种化合物中,阴、阳离子物质的量之比分别为1:1和1:2 | |
| C. | X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物 | |
| D. | Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物 |
18.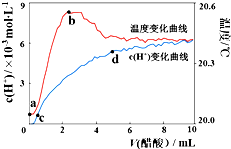 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
5.取底部沉积有NaCl固体的NaCl饱和溶液,滴加1-2滴浓盐酸(约12mol/L),即可观察到大量白色沉淀产生.根据上述事实及所学知识,下列说法正确的是( )
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
①析出的沉淀是NaCl
②推测饱和氯化钠溶液的浓度小于12mol/L
③得到的混合溶液中存在着溶解平衡
④加入浓盐酸后,NaCl的溶解速率小于NaCl的沉淀速率
⑤加热浓缩或降温也可以使NaCl析出.
| A. | 全部 | B. | ①③④ | C. | ①③④⑤ | D. | ②③④⑤ |
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
(1)铝离子的结构示意图为 .
.
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
(6)钢铁的析氢腐蚀简单示意图如图所示,正极的电极反应式为2H++2e-=H2↑.该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图.
 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
2.下列说法正确的是( )
| A. | 取用金属钠时,多余的钠应放置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在100mL容量瓶内溶解并稀释至刻度线,得到0.50mol•L-1氢氧化钠溶液 | |
| D. | 萃取过程中的振摇操作时,需将漏斗上口向下倾斜,下部支管口斜向上方 |
19.对于化学反应A(g)+3B(g)?3C(g),下列措施既可加快反应速度,有可提高A的转化率的是( )
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
1.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 甘油可用于配制化妆品 | |
| B. | 福尔马林可用于食品、标本、木材等的防腐 | |
| C. | 食品饮料中的菠萝酯,只能从菠萝中提取,不能通过有机合成生产 | |
| D. | 在野外,被黑蚂蚁蜇伤后,涂抹烧碱液可以缓解因注入皮肤内的蚁酸带的疼痛 |