题目内容
20.下列气态氢化物中最稳定的是( )| A. | PH3 | B. | NH3 | C. | H2O | D. | CH4 |
分析 根据元素非金属性越强,氢化物的稳定性越强来判断,同周期从左到右元素的非金属性增强,同主族从上到下非金属性减弱.
解答 解:对于C、N、O、P四种非金属元素来说,C、N、O处于同一周期,同周期从左到右元素的非金属性增强,即非金属性C<N<O;
N和P处于同一主族,同主族从上到下非金属性减弱,即非金属性N>P.
因此,非金属性最强的是O元素,元素非金属性越强,氢化物的稳定性越强,则氢化物最稳定的是H2O.
故选C.
点评 本题考查了元素周期律,侧重于非金属性和氢化物的稳定性比较的考查,题目难度不大,注意把握同主族和同周期元素性质的变化规律.

练习册系列答案
相关题目
10.80℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=3的碳酸中:c(H+)=3.0mol•L-1 | |
| B. | 饱和乙酸钠溶液中:c(Na+)=c(CH3COO-) | |
| C. | pH为2的盐酸中:c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=13的烧碱溶液中:c(OH-)=1.0×10-1mol•L-1 |
11.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
8.下列表示对于化学反应的离子方程式正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 误将洁厕灵与84消毒液混合:H++Cl-+HClO=Cl2↑+H2O | |
| C. | 酸性高锰酸钾和过氧化氢制取少量氧气:2MnO4-+12H++4H2O2═4Mn2++7O2↑+10H2O | |
| D. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O |
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
(1)铝离子的结构示意图为 .
.
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
(6)钢铁的析氢腐蚀简单示意图如图所示,正极的电极反应式为2H++2e-=H2↑.该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图.
 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
5.下列有关实验原理或操作正确的是( )
| A. | 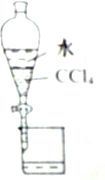 分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | 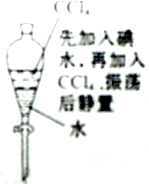 液体分层,下层呈无色 | |
| D. | 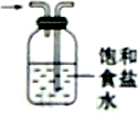 除去氯气中的氯化氢 |
12.某直链一元醇14g能与金属钠完全反应,生成0.2克H2,则此醇的同分异构体数目为( )
| A. | 6个 | B. | 7个 | C. | 8个 | D. | 9个 |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,40 g SO3所含的氧原子的数目为1.5 NA | |
| B. | 5.6 g铁与足量氯气或硫蒸气反应转移的电子数均为0.3 NA | |
| C. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| D. | 常温下5.6 g铁投入到足量浓硝酸中反应,转移电子数为0.3 NA |
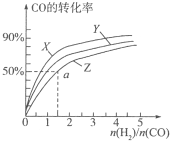 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1