题目内容
11.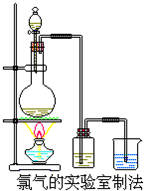 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.(1)写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(2)上述反应中,盐酸表现出性质是酸性、还原性.
(3)兴趣小组的同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为错误的是CD.
A.NaOH 溶液 B.Na2CO3溶液 C.饱和食盐水 D.浓硫酸
(4)实验室取含氯化氢14.6g的浓盐酸与足量的二氧化锰反应,
可以收集到标准状况下的氯气体积小于(填大于、小于或等于)2.24L,原因是随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完.
分析 (1)浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水;
(2)浓盐酸与二氧化锰反应中,部分氯化氢中的氯离子化合价升高,被氧化;部分氯离子与锰离子结合生成氯化锰;
(3)根据氯气的化学性质判断;
(4)二氧化锰在加热条件下只能氧化浓盐酸,与稀盐酸不反应.
解答 解:(1)浓盐酸与二氧化锰在加热条件下反应的离子化学方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(2)浓盐酸与二氧化锰反应中,部分氯化氢中的氯离子化合价升高,被氧化,表现还原性;部分氯离子与锰离子结合生成氯化锰,表现酸性;
故答案为:酸性、还原性;
(3)氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,故可以用来吸收氯气;
氯气溶于水,反应生成盐酸和次氯酸,盐酸能够与碳酸钠溶液反应,故可以用来吸收氯气;
氯气在饱和食盐水中溶解度减小,故不能用来吸收残余氯气;
氯气不与浓硫酸反应,也不能溶解于浓硫酸,故不能用来吸收残余氯气;
故答案为:CD;
(4)14.6g氯化氢的物质的量为:$\frac{14.6g}{36.5g/mol}$=0.4mol,依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,如果氯化氢完全反应,生成氯气的物质的量为0.1mol,标况下体积为:2.24L,但是二氧化锰在加热条件下只能氧化浓盐酸,与稀盐酸不反应,随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完,所以产生的氯气小于2.24L,
故答案为:小于; 随着反应的进行,氯化氢不断消耗及挥发,使浓盐酸变成稀盐酸,反应停止,氯化氢不能反应完.
点评 本题考查了实验室制备氯气的方法和原理分析,氯气性质的分析应用,明确反应的原理,熟悉常见的设备是关键,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
| A. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| B. | 夏天,打开冰镇啤酒瓶,立即冒出大量泡沫 | |
| C. | 生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好 | |
| D. | 侯氏制碱工业中,降温析出副产品NH4Cl之前,向溶液中既撒NaCl固体又通入足量NH3 |
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
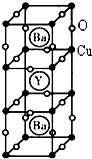 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(2)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上十二种元素分别属于s区、d区和ds区,则属于s区的元素有2种,属于d区的元素有8种.
(3)试比较:第一电离能I1(Ga)<I1(Ge)(填“>”、“<”或“=”).
(4)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价.
①该物质的化学式为:YCu3Ba2O7.
②该物质中Cu2+与Cu3+的原子个数比为:2:1.
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
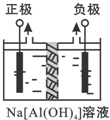 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: