题目内容
12.下列物质中含有共价键的离子化合物是( )| A. | BaCl2 | B. | H2O | C. | HCl | D. | Ba(OH)2 |
分析 金属元素和非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物.
解答 解:A.氯化钡中钡离子和氯离子之间只存在离子键,属于离子化合物,故A错误;
B.水分子中O-H原子之间存在共价键,属于共价化合物,故B错误;
C.HCl分子中H-Cl原子之间只存在共价键,属于共价化合物,故C错误;
D.氢氧化钡中钡离子和氢氧根离子之间存在离子键、H-O原子之间存在共价键,属于离子化合物,故D正确;
故选D.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,注意A中不存在共价键,为易错点.

练习册系列答案
相关题目
3.100℃时,若将0.100mol N2O4气体放入1L密闭容器中,发生反应N2O4?2NO2,c(N2O4)随时间的变化如表所示.回答下列问题:
(1)在0~40s时段,化学反应速率v(NO2)为0.0025mol•L-1•s-1;
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
此温度下的化学平衡常数K为0.36.
(2)下列能说明该反应达到平衡状态的是BD
A.2v(N2O4)=v(NO2)
B.体系的颜色不再改变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)该反应达到平衡后,降温至50℃,c(N2O4)变为0.080mol•L-1,混合气体的颜色变浅(填“深”或“浅”),该反应的正反应为吸热反应(填“吸热”或“放热”),判断的理由是降低温度平衡向放热反应方向移动,降低温度c(N2O4)浓度增大,平衡逆向移动.
(4)该反应达平衡后,若只改变一个条件,达新平衡时,下列能使NO2的体积分数增大的是:BC
A.充入一定量的NO2
B.增大容器的容积
C.分离出一定量的NO2
D.充入一定量的N2
(5)100℃时,若将9.2gNO2和N2O4气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)<v逆(N2O4).(填“>”、“=”或“<”)
20.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | CH3CH2CH2CH3 | B. |  | C. | CH3CH2CH3 | D. |  |
7.下列说法均摘自某些科普杂志,你认为无科学性错误的是( )
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可以用嘴吮吸铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室放置数盆清水,这样可有效的吸收CO,防止煤气中毒 | |
| C. | 汽水浇灌农田有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用 | |
| D. | 纯碱又名烧碱,成分是氢氧化钠 |
4.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| C. | Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
1.下列说法中错误的是( )
| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
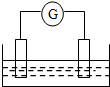 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: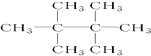 .
.