题目内容
6. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )?| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W? | |
| C. | 原子半径:T>Q>R | |
| D. | T的最高价氧化物对应水化物为强碱 |
分析 由短周期元素R、T、Q、W的位置,可知T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素,结合元素周期律解答.
解答 解:由短周期元素R、T、Q、W的位置,可知T、Q、W为第三周期的元素,R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为Si元素,W为S元素,R为N元素.
A.非金属性N>Si,故最简单气态氢化物的热稳定性为NH3>SiH4,故A正确;
B.非金属性Si<S,故最高价氧化物对应水化物的酸性为H2SiO3<H2SO4,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:T>Q>R,故C正确;
D.T的最高价氧化物对应水化物为氢氧化铝,属于弱碱,故D错误;
故选D.
点评 本题考查位置结构性质关系应用,侧重对元素周期律的考查,有利于基础知识的巩固.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列物质注入水中,振荡后静置,能分层浮于水面的是( )
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
①溴苯 ②乙酸乙酯 ③乙醇 ④硝基苯 ⑤CCl4 ⑥苯.
| A. | ①②③ | B. | ①②③⑥ | C. | ②③⑥ | D. | ②⑥ |
17.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
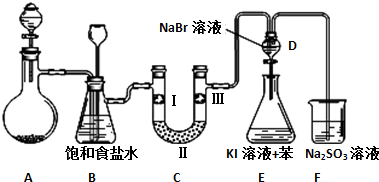
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色,事实上该现象并不能说明溴的非金属性强于碘,原因是Cl2+2I-=I2+2Cl-(用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号);
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因氯、溴、碘同主族,从上到下,原子半径逐渐增大,得电子能力减弱,元素非金属性减弱;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方程式SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
14.叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质.NaN3受撞击会生成一种化合物Na3N,下列关于这两种化合物的说法不正确的是( )
| A. | 两者均属于离子化合物 | |
| B. | 两种化合物中所含有化学键类型相同 | |
| C. | Na3N与盐酸反应可得到2种盐 | |
| D. | Na3N中N3-半径比Na+半径大 |
11.下列化学用语不正确的是( )
| A. | 氯化钠的电子式 | B. | 中子数为9的氧原子符号${\;}_{8}^{17}$O | ||
| C. | 氮分子的电子式 | D. | 钾离子的结构示意图  |
15.某种有机物2mol在氧气中充分燃烧,共消耗5mol氧气,生成二氧化碳和水各4mol,由此可以得到的结论是( )
| A. | 该有机物分子中不含有氧原子 | |
| B. | 该有机物分子中含一个氧原子 | |
| C. | 该有机物一个分子中含2个氧原子 | |
| D. | 不能确定该有机物分子中是否含有氧原子及其个数 |
16.下列说法正确的是( )
| A. | 按系统命名法,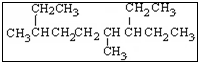 名称:4,7-二甲基-3-乙基壬烷 名称:4,7-二甲基-3-乙基壬烷 | |
| B. | 元素分析仪可以同时对碳、氢、氧、硫等多种元素进行分析 | |
| C. | 用相同浓度的乙醇和苯酚水溶液,分别与相同质量的金属钠反应,来比较两者羟基上氢的活性 | |
| D. | 等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |

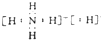 .
.