题目内容
7.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3,Z元素可形成正一价离子.下列说法正确的是( )| A. | Y元素的基态原子核外原子排布式为1s22s22p2 | |
| B. | Y元素与Z元素可以形成化合物Z2Y2 | |
| C. | X元素的基态原子中3个未成对电子的能量不相同 | |
| D. | X元素与Z元素可以形成离子化合物XZ3 |
分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成正一价离子,符合题意.
解答 解:X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成正一价离子,符合题意.
A.Y为O元素,基态原子核外原子排布式为1s22s22p4,故A错误;
B.Y元素与Z元素可以形成化合物H2O2,故B正确;
C.X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,3个未成对电子的能量相同,故C错误;
D.X元素与Z元素可以形成化合物AsH3,属于共价化合物,故D错误,
故选B.
点评 本题考查结构与位置关系、核外电子排布规律等,难度中等,推断元素Y是关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
17.下列除去括号内杂质的有关操作正确的是( )
| A. | 苯(苯酚):加浓溴水振荡,分液 | |
| B. | 硝酸(硝酸镁):加热,蒸馏 | |
| C. | 肥皂液(甘油):加食盐颗粒,过滤 | |
| D. | 乙酸乙酯(乙酸):加氢氧化钠溶液,分液 |
18.下列反应中的能量变化与图相符的是( )


| A. | 煤的气化 | B. | 乙醇燃烧 | C. | 中和反应 | D. | 铝热法炼铁 |
2.甲溶液的PH=4,乙溶液的PH=1,则甲溶液与乙溶液中C(H+)之比是( )
| A. | 1000 | B. | C. | 3 | D. |
12.铝元素对人体健康有危害.因此,1989年世界卫生组织正式把铝确定为食品污染源之一而须加以控制.铝在下列应用场合使用时应加以控制的是( )
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤用明矾净水 ⑥明矾和小苏打制食品膨松剂 ⑦制易拉罐 ⑧用氢氧化铝凝胶制胃舒平 ⑨包装糖果盒小食品.
| A. | ③⑤⑧⑨ | B. | ⑥⑧⑨ | C. | ③⑤⑨ | D. | ③⑤⑥⑦⑧⑨ |
19.下列有关分类的观点正确的是( )
①氨水、醋酸、氢氧化铝都属于弱电解质
②生物质能、沼气和乙醉都是可再生能源
③碳素钢、不锈钢和目前流通的硬币都属于合金
④铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
⑤由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应.
①氨水、醋酸、氢氧化铝都属于弱电解质
②生物质能、沼气和乙醉都是可再生能源
③碳素钢、不锈钢和目前流通的硬币都属于合金
④铅蓄电池、锂电池、碱性锌锰电池都属于二次电池
⑤由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ③⑤ |
16.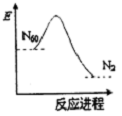 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
 最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )
最近科学家确认,存在着一种具有空心,且类似于足球结构的分子N60,N60转化N2的能量变化如图所示.下列说法正确的是( )| A. | N60转化N2是物理变化 | B. | N2不如N60稳定 | ||
| C. | N60转化N2是吸收能量的过程 | D. | N60可能成为一种好的火箭材料 |
17.已知反应NO2(g)+CO(g)═NO(g)+CO2(g)的能量变化如图所示,下列说法正确的是( )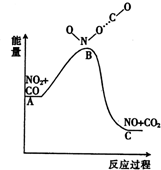

| A. | 该反应为吸热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | NO和CO2的键能总和大于NO2和CO的键能总和 | |
| D. | 1 molNO2(g)和1 mol CO(g)的总能量低于 1mol NO(g)和1 molCO2(g)的总能量 |