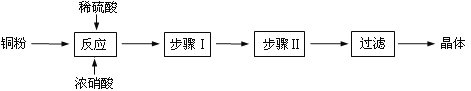
题目内容
【题目】用VSEPR理论预测下列粒子的立体结构,其中正确的( )
A.NO3-为平面三角形B.SO2为直线形
C.BeCl2为V形D.BF3为三角锥形
【答案】A
【解析】
VSEPR理论即价层电子对互斥理论,确定价层电子对的个数(包括σ键电子对和孤电子对),即可确定粒子的立体结构。
A.NO3-的σ键电子对是3,孤电子对=![]() (5+1-2×3)=0,所以为NO3-平面三角形,A正确;
(5+1-2×3)=0,所以为NO3-平面三角形,A正确;
B.SO2的σ键电子对是2,孤电子对=![]() (6-2×2)=1,所以SO2的VSEPR模型是平面三角形,略去孤电子对,SO2为V形,B错误;
(6-2×2)=1,所以SO2的VSEPR模型是平面三角形,略去孤电子对,SO2为V形,B错误;
C.BeCl2的σ键电子对是2,孤电子对=![]() (2-2×1)=0,所以BeCl2为直线形,C错误;
(2-2×1)=0,所以BeCl2为直线形,C错误;
D.BF3的σ键电子对是3,孤电子对=![]() (3-1×3)=0,所以的BF3为平面三角形,D错误;
(3-1×3)=0,所以的BF3为平面三角形,D错误;
故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
请回答下列问题:
(1)x的值是___。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__。
(3)60s时,PCl5的转化率是__。
(4)达平衡时,容器中Cl2的体积分数是__(结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__mol·L-1。