题目内容
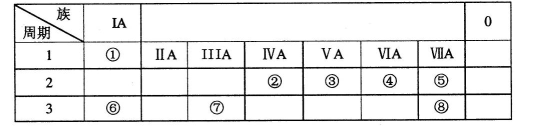
下列说法中,正确的是
| A.酸性:盐酸>氢硫酸,则得电子能力:Cl>S |
| B.第二周期元素的最高正化合价从左到右依次升高 |
| C.元素原子的最外层电子数越多,其氢化物稳定性越强 |
| D.共价化合物中只存在共价键,离子化合物中一定含有离子键 |
D
试题分析:A、非金属性强弱与非金属氢化物的酸性强弱无关系,而与最高价氧化物的水化物的酸性强弱有关系,即高氯酸的酸性强于硫酸,则得电子能力:Cl>S,A不正确;B、第二周期的F没有正价,O没有最高价,所以选项B不正确;C、非金属性越强,氢化物的稳定性越强。但元素原子的最外层电子数越多,其氢化物稳定性不一定越强,C不正确;D、全部由共价键形成的化合物是共价化合物,含有离子键的化合物是离子化合物,因此共价化合物中不可能含有离子键,但离子化合物中可能含有共价键,D正确,答案选D。

练习册系列答案
相关题目


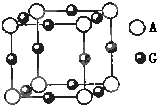 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。