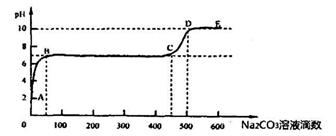
题目内容
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。

(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。

(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
(14分)(1)sp3(2分) (2)3d104s1(2分) (2分)
(2分)
(3)HClO4>H2SO4 (2分);(4)2H++NO3-+e-=NO2↑+H2O(2分)
(5) (2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
(2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
 (2分)
(2分)(3)HClO4>H2SO4 (2分);(4)2H++NO3-+e-=NO2↑+H2O(2分)
(5)
 (2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
(2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)试题分析:A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满,所以B是氯元素,则A是Al;C原子的p轨道中有3个未成对电子,因此C是第ⅤA族元素。其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大,所以C是氮元素;D的最高化合价与最低化合价代数和为4,则D是第ⅥA族元素。其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池,因此D是S元素;E元素的基态原子核外有六种运动状态的电子,所以E是碳元素;F元素的单质为紫红色固体,可通过“湿法冶金”而得,则F是铜。
(1)CB3分子是NCl3,中心原子N原子含有的孤对电子对数=(5-3×1)÷2=1,杂化轨道数目为4,为三角锥型,N原子采取sp3杂化。
(2)铜元素的原子序数是29,则根据构造原理和洪特规则可知,铜原子的外围电子排布式为3d104s1;根据晶胞结构并依据均摊法可知,黑球个数=8×
 =1个。白球个数=6×
=1个。白球个数=6× =3个,所以白球和黑球的个数之比是3:1,因此黑球是Au,白球是Cu。
=3个,所以白球和黑球的个数之比是3:1,因此黑球是Au,白球是Cu。(3)非金属性越强,最高价氧化物的水化物的酸性越强。氯元素的非金属性强于硫元素的非金属性,所以最高价氧化物的水化物的酸性强弱顺序是HClO4>H2SO4。
(4)由于常温下单质铝在浓硝酸中发生钝化,所以在该原电池中铜是负极,失去电子。铝是正极,溶液中的NO3-得到电子,则正极电极反应式是2H++NO3-+e-=NO2↑+H2O。
(5)N和H元素形成的18电子分子是N2H4,其电子式是
 。
。(6)24g碳的物质的量为24g÷12g/mol=2mol。标准状况下的33.6L氧气的物质的量为33.6L÷22.4L/mol=1.5mol。所以n(C):n(O)=2mol:1.5mol×2=1:1.5,故燃烧生成物为CO、CO2.令CO、CO2的物质的量分别为xmol、ymol,根据C原子守恒有x+y=2,根据O原子守恒有x+2y=1.5mol×2,联立方程,解得x=1,y=1。碳的燃烧热为ykJ/mol,故生成1molCO2放出的热量为ykJ,所以生成1molCO放出的热量为xkJ-ykJ=(x-y)kJ,则1mol碳燃烧生成CO放出的热量为(x-y)kJ。因此1mol碳与O2反应生成CO时的热化学方程式为C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol。

练习册系列答案
相关题目
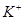 、
、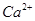 、
、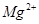 的离子半径依次增大,还原性依次增强
的离子半径依次增大,还原性依次增强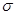 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________