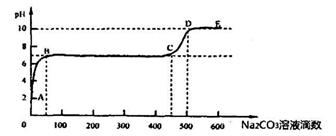
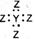题目内容
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示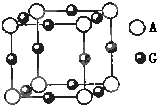 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示
 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
(共14分)(1)8(2分) 平面三角形(2分) 1s22s22p63s23p5(2分) [Cu(NH3)4]2+(2分)
(2)NaCl的熔点高于SiCl4,因为NaCl是离子晶体,SiCl4是分子晶体。(2分)
(3)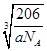 (2分) (4)Al2Cl6(2分)
(2分) (4)Al2Cl6(2分)
(2)NaCl的熔点高于SiCl4,因为NaCl是离子晶体,SiCl4是分子晶体。(2分)
(3)
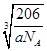 (2分) (4)Al2Cl6(2分)
(2分) (4)Al2Cl6(2分)试题分析:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的,因此A是N。D、E原子核外的M层中均有两个未成对电子,则D的M层为3s2 3p2,是Si。E的M层为3s2 3p4,是S。B、E两元素组成化合物B2E的晶体为离子晶体,所以B为IA族的金属,B应该是钠元素。G原子核外最外层电子数与B相同,其余各层均充满,且G的原子序数最大,因此G是铜。C、F的原子均有三个能层,因此C、F在第三周期。C的逐级电离能前三个数据接近,第四电离能突变,所以易失去三个电子,为第ⅢA族元素,C是铝。C与F能形成原子数目比为1:3、熔点为190℃的化合物Q ,说明F为-1价,即F为Cl元素,Q是AlCl3。
(1)金属钠的单质晶体为体心立方堆积模型,其配位数为8;E元素的最高价氧化物分子是三氧化硫,其中心原子S原子含有的孤对电子对数=(6-3×2)÷2=0,所以三氧化硫分子的立体构型是平面三角形。根据构造原理可知,Cl元素原子的核外电子排布式是1s22s22p63s23p5;G的高价离子Cu2+与A的简单氢化物NH3形成的配离子的化学式为[Cu(NH3)4]2+。
(2)B、D分别与F形成的化合物分别是氯化钠和四氯化硅。因为NaCl是离子晶体,SiCl4是分子晶体,所以NaCl的熔点高于SiCl4。
(3)根据晶胞的结构可知,N原子在顶点,含有的个数=8×
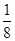 =1个。铜在棱边,含有的个数=12×
=1个。铜在棱边,含有的个数=12×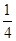 =3个,即化学式为Cu3N。设边长为x cm,则
=3个,即化学式为Cu3N。设边长为x cm,则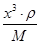 ×NA=1,解得x=
×NA=1,解得x=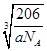 。
。(4)根据M=ρ×Vm=5.00g/L×53.4L/mol=267,是AlCl3相对分子质量的267÷133.5=2倍,所以其化学式为Al2Cl6。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________