题目内容
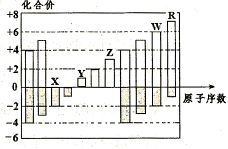
下图为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题
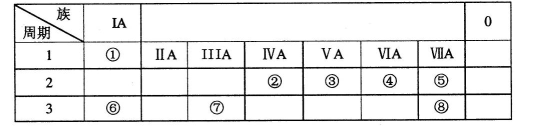
(1)元素⑧形成的简单阴离子的结构示意图为____;元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是 (用离子符号表示)。
(2)元素③和④可以形成多种化合物,其中化合物甲为这些化合物中相对分子质量最小的。若将化合物甲与元素④的单质按物质的量之比为4:1通人含足量由元素①、④和⑥组成的化合物乙的水溶液中,气体恰好完全反应且生成的盐只有一种,其反应的化学方程式为________。
(3)元素②和④组成的一种化合物与元素④的单质和化合物乙的水溶液在一定条件下可形成燃料电池,写出该燃料电池负极的电极反应式 .
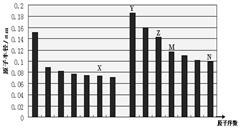
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
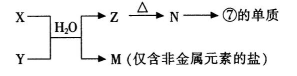
①X溶液与Y溶液反应的离子方程式为___ _。
②N→⑦的单质反应的化学方程式为___ _。
③M的水溶液显酸性,用离子方程式解释其原因___ _。

(1)元素⑧形成的简单阴离子的结构示意图为____;元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是 (用离子符号表示)。
(2)元素③和④可以形成多种化合物,其中化合物甲为这些化合物中相对分子质量最小的。若将化合物甲与元素④的单质按物质的量之比为4:1通人含足量由元素①、④和⑥组成的化合物乙的水溶液中,气体恰好完全反应且生成的盐只有一种,其反应的化学方程式为________。
(3)元素②和④组成的一种化合物与元素④的单质和化合物乙的水溶液在一定条件下可形成燃料电池,写出该燃料电池负极的电极反应式 .
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为___ _。
②N→⑦的单质反应的化学方程式为___ _。
③M的水溶液显酸性,用离子方程式解释其原因___ _。
(19分)(1)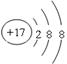 (2分)r(O2-)>r(Na+) >r(Al3+)(2分)
(2分)r(O2-)>r(Na+) >r(Al3+)(2分)
(2)4NO+O2+4NaOH=4NaNO2+2H2O (3分) (3)CO+4OH--2e-=CO32-+2H2O (3分)
(4)①Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(3分)
②2Al2O3(熔融) 4Al+3O2↑(3分)③NH4+
4Al+3O2↑(3分)③NH4+ NH3·H2O+H+(3分)
NH3·H2O+H+(3分)
 (2分)r(O2-)>r(Na+) >r(Al3+)(2分)
(2分)r(O2-)>r(Na+) >r(Al3+)(2分)(2)4NO+O2+4NaOH=4NaNO2+2H2O (3分) (3)CO+4OH--2e-=CO32-+2H2O (3分)
(4)①Al3++3NH3+3H2O=Al(OH)3↓+3NH4+(3分)
②2Al2O3(熔融)
 4Al+3O2↑(3分)③NH4+
4Al+3O2↑(3分)③NH4+ NH3·H2O+H+(3分)
NH3·H2O+H+(3分)试题分析:根据元素在周期表中的相对位置可知,元素①~⑧分别是①是H,②是C,③是N,④是O,⑤是Na,⑥是Na,⑦是Al,⑧是Cl。
(1)元素⑧形成的简单阴离子是18电子微粒,其离子的结构示意图为
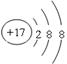 ;核外电子排布相同的微粒其微粒半径随原子序数的增大而减小,则元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是r(O2-)>r(Na+) >r(Al3+)。
;核外电子排布相同的微粒其微粒半径随原子序数的增大而减小,则元素④、⑥、⑦形成的简单离子的半径由大到小的顺序是r(O2-)>r(Na+) >r(Al3+)。(2)元素③和④是N和O,二者形成多种化合物中相对分子质量最小的是NO,即甲是NO。由元素①、④和⑥组成的化合物乙是氢氧化钠。若将化合物甲与元素④的单质按物质的量之比为4:1通人含足量氢氧化钠的水溶液中,气体恰好完全反应且生成的盐只有一种。氧气在反应中得到4个电子,所以根据电子的得失守恒可知,4分子NO失去4个电子,则1 分子NO失去1个电子,氮元素的化合价从+2价升高到+3价,即氧化产物是亚硝酸钠,因此其反应的化学方程式为4NO+O2+4NaOH=4NaNO2+2H2O。
(3)元素②和④组成的一种化合物与元素④的单质和化合物乙的水溶液在一定条件下可形成燃料电池,由于CO2不能燃烧,所以C和O生成的化合物是CO。在原电池中负极失去电子,正极得到电子,所以CO在负极通入,氧气在正极通入。由于电解质是氢氧化钠溶液,所以该燃料电池负极的电极反应式为CO+4OH--2e-=CO32-+2H2O。
(4)①由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z加热生成N,N又生成⑦的单质,即单质是铝,所以N是氧化铝,电解熔融的氧化铝生成单质铝。则Z是氢氧化铝,氢氧化铝分解生成氧化铝。分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+可知X、Y是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+。
②根据以上分析可知,N→⑦的单质反应的化学方程式为2Al2O3(熔融)
 4Al+3O2↑。
4Al+3O2↑。③铵盐在水溶液中,NH4+水解,溶液显酸性,反应的离子方程式是NH4+
 NH3·H2O+H+。
NH3·H2O+H+。
练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。